חומר מספר קוונטי: סוגים, בעיות לדוגמה (סיכום)
טוען...
כאשר מוסבר בפשטות, המספר הקוונטי הוא מספר המתאר את מיקומם של אלקטרונים ורמות אנרגיה או המרחק מגרעין האטום בבת אחת, צורת האורביטלים, כיוון האורביטלים והספין של אלקטרונים הכלולים במודל האטום המכני קוונטים.
לכל אטום יש אורביטל, ולאורביטלים האטומיים יש רמות אנרגיה שונות. לרמת האנרגיה של אותו מסלול תהיה רמת אנרגיה שונה אם האטומים שונים, כך שאורביטל ה-1 של מימן שונה ברמת האנרגיה מהאורביטל ה-1 של הליום.
רשימת תכנים
הגדרה של מספרים קוונטיים

בפונקציית הגל, למספר הזה יש משמעות מיוחדת לתיאור מצב המצב הקוונטי. המספרים הללו יכולים לתאר את מצב האלקטרונים באטום. בשנת 1926 הציע ארווין שרדינגר את תורת מכניקת הקוונטים.
תיאוריה זו מסבירה את מבנה האטום. מודל אטומי מכאני קוונטי זה בא לידי ביטוי במשוואה מתמטית, כלומר משוואת הגלים. פתרון המשוואה עבור אטום המימן מניב פונקציית גל או מסלול אטומי.
מסלול אטומי זה יתאר את מצב המספר הקוונטי של האלקטרונים באטום. הריבוע של פונקציית הגל פירושו שיש סבירות גבוהה לקבל אלקטרון בנפח נתון של חלל סביב גרעין האטום.
כמו עקרון אי הוודאות של הייזנברג, לא ניתן לקבוע את מיקומם של אלקטרונים באטומים. כל מה שניתן לדעת הוא המיקום שבו סביר להניח שהאלקטרון יימצא.
סוגי מספרים קוונטיים
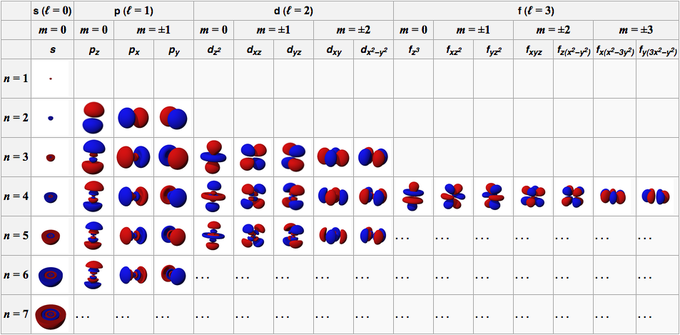
מסלולו של אטום נוצר מתפקודי הגלים המרכיבים את המסלול. בתנאים כלליים, מאפייני המסלול של אטום מתוארים על ידי ארבעה מספרים, כלומר n, l, m ו-s.
1. מספר קוונטי ראשי (n)
מספר זה מורכב ממספרים שלמים חיוביים המתחילים מ-1 (אחד), מה שהופך את הערך של n ל-1, 2, 3, 4, 5 וכן הלאה. מספר זה מתייחס לקליפה שתפוסה על ידי מסלול באטום.
2. מספר קוונטי של אזימוט (l)
מספר זה מורכב ממספרים שלמים חיוביים המתחילים מ-0 (אפס), מה שהופך את הערך של l ל-0, 1, 2, 3, 4, 5 וכן הלאה. למספרים הללו יש סימן משלהם; 0 הוא מסלול s, 1 הוא מסלול p, 2 הוא מסלול d, ו-3 הוא מסלול f.
3. מספר קוונטי מגנטי (מ')
מספר זה מורכב ממספרים שלמים המתחילים מ-0 (אפס) עד +/- 1, כך שערך המספרים עבור כל מסלול אינו זהה. עבור מסלול s, אז m הוא 0 כי הוא נמצא במסלול s, ואז l הוא 0. עם זאת, עבור d orbitals שבהם l הוא 2, אז m הוא -2, -1, 0, 1 ו-2.
4. מספרי ספין קוונטיים
אם המספר הקודם מציין את כיוון האורביטלים, מספר זה מתאר את הספין של האלקטרון שיש לו ערכים של 1/2 ו -1/2.
לקרוא: מכניקה קוואנטית
אורביטלים ומספרים קוונטיים
לכל מסלול אטומי קבוצה ייחודית של שלושה מספרים קוונטיים. המספרים הללו הם המספר הקוונטי העיקרי (n), אזימוט או תנע זוויתי (l), ומגנטי (m). שלושת המספרים הללו ממחישים כמה דברים.
אלה כוללים תיאור רמת האנרגיה של האורביטלים, הגודל, הצורה והכיוון של ההתפלגות הרדיאלית האפשרית של האורביטלים האטומיים. לאחר מכן, יש את מספר הספין (s), מספר שאומר לך את הספין של אלקטרון במסלול.
צורת מסלול אטומי
ישנן ארבע צורות של אורביטלים אטומיים המבוססים על ערכי מספר האזימוט שלהם. ארבע צורות המסלול הן כדלקמן.
1. אורביטלים של
מסלול s הוא מסלול עם l = 0. צורתו כדורית, עם גרעין האטום במרכז. מכיוון שלכדור יש רק כיוון אחד, לכל אורביטלים S יש רק ערך אחד של m, כלומר m = 0. למסלול 1s יש את צפיפות האלקטרונים או הצפיפות הגבוהה ביותר בגרעין האטום.

לאחר מכן צפיפות האטום יורדת לאט ככל שהיא מתרחקת מגרעין האטום. למסלול 2s שני אזורים בעלי צפיפות אלקטרונים גבוהה. משני האזורים, יש צומת כדורי, שבו ההסתברות לפגוש אלקטרונים באזור זה פוחתת לאפס.
התבנית של הגדלת קודקודי המסלול תמשיך עם ה-4, 5, וכן הלאה.
2. p. אורביטלים
מסלול p הוא מסלול עם l = 1. הצורה היא כמו בלון מעוות, מצויד בשתי אונות. האונות נמצאות בצדדים מנוגדים של גרעין האטום. גרעין האטום נמצא במישור הצומת האורביטלי p, בין שתי האונות עם צפיפות אלקטרונים גבוהה.

למסלול p יש שלושה סוגים של אוריינטציה מרחבית, כלומר Px, Py ו-Pz, כך שיש שלושה ערכים אפשריים של m, כלומר -1, 0 או +1. שלושת האורביטלים ממוקמים בניצב זה לזה על צירי x, y ו-z בקואורדינטות קרטזיות. הצורה, הגודל והאנרגיה זהים.
3. ד מסלול
מסלול d הוא מסלול עם l = 2. למסלול זה חמישה כיוונים שונים, המעניקים לו חמישה ערכים אפשריים של m, כלומר -2, -1, 0, +1 או +2. ארבעת האורביטלים של D שלהם הם dxy, dxz, dyx ו-d2-y2.
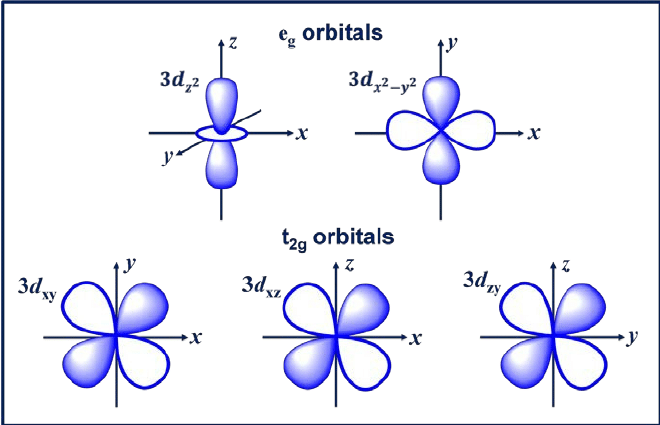
לאורביטלים הללו יש ארבע אונות בצורת עלה תלתן. מסלול ה-d הבא הוא dzw, שיש לה שתי אונות עיקריות על ציר ה-Z וחלק אחד בצורת סופגנייה באמצע.
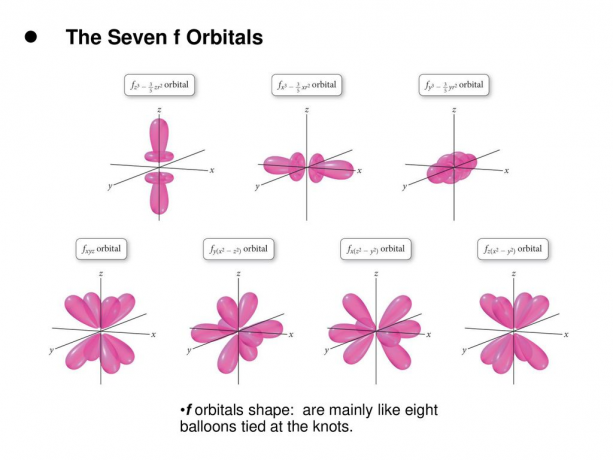
4. ו. אורביטלים
האורביטל f הוא מסלול עם l = 3. למסלול זה יש שבעה סוגי כיוון, בדיוק כפי שיש שבעה ערכים אפשריים של m (2l + 1 = 7). לכל אורביטלים F יש צורות מורכבות עם מספר משתנה של אונות.
לקרוא: תצורת האלקטרון
תצורת האלקטרון
לאחר שתבינו כיצד הקשר בין קיומם של אלקטרונים באטומים ובאורביטלים בתורת האטום של מכניקת הקוונטים, בהמשך תלמדו על תצורת אלקטרונים, כיצד לסדר אלקטרונים באורביטלים בקליפות אטומיות רב אלקטרון.
1. הכלל של Aufbau
פרסומת
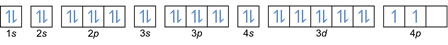
בכלל זה, נאמר כי יש למלא אלקטרונים מרמות אנרגיה נמוכות לגבוהות יותר. ניתן לראות את רמות האנרגיה של האורביטלים בסידור האטומים בטבלה המחזורית של היסודות הכימיים.
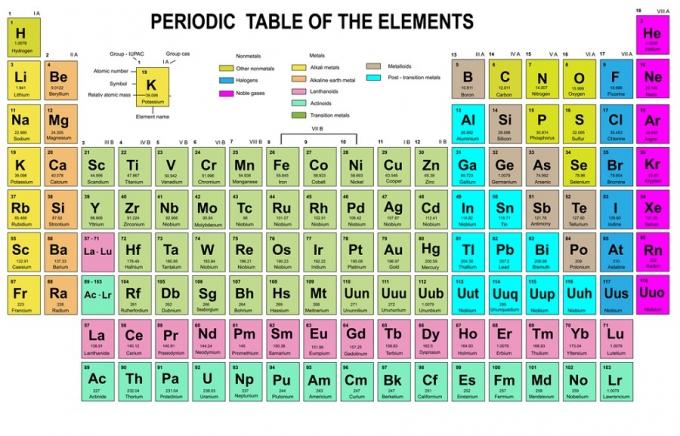
בטבלה, הצד השמאלי התחתון כתוב באדום כאשר יש בלוק s, כחול הוא לבלוק d, צהוב הוא לבלוק p, וירוק הוא לבלוק f. בעוד כל שורה היא עור.
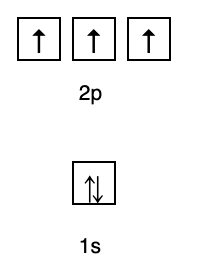
בהתבסס על סידור זה, אתה יכול לראות שסדר רמות האנרגיה הוא 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, וכן הלאה.
2. מאה כללים
כלל זה קובע שאם יש אורביטלים באותה רמת אנרגיה, אז האלקטרונים חייבים להיות מלאים במקביל עד שכל האורביטלים באותה רמת אנרגיה מתמלאים באלקטרונים, כפי שמוצג באיור הבא.
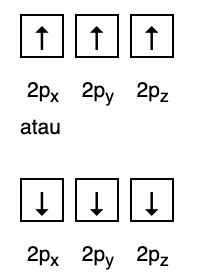
בינתיים, הנתון הבא אינו תואם את המילוי לפי חוק האנד.
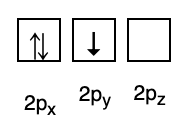
3. האיסור של פאולי
איסור פאולי קובע שלאלקטרונים לא יכול להיות אותו מספר קוונטי כשהם מלאים באורביטל, ולכן יש מספר ספין(ים) עם ערך של +1/2. האנרגיה הנמוכה ביותר היא זו עם המספר הגבוה ביותר של אלקטרונים מזווגים וספינים מקבילים.
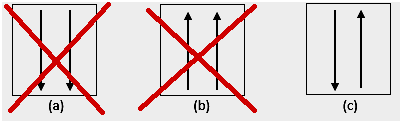
4. אֲנוֹמַלִיָה

על פי ניסויים, קיימות חריגות בתצורת האלקטרונים לפי הכללים שהוזכרו לעיל. תת-המעטפת d בדרך כלל מלאה למחצה או מלאה. למשל, עבור 24Cr, תצורת האלקטרונים שלו: [Ar] 4s1 3d5, יציבה יותר מ-[Ar] 4s2 3d4.
בנוסף, תצורת האלקטרונים עבור 29Cu: [Ar] 4s1 3d10, יציב יותר מ-[Ar] 4s2 3d9. בינתיים, תצורת האלקטרונים עבור יונים מונוטומיים כגון K+, נא+, Ca2+, בר–, ש2-, וכן הלאה ניתן לקבוע על ידי האטום הנייטרלי תחילה.
עבור קטיונים או יונים בעלי מטען חיובי, A מונוטומיx+ עם מטען של x+, אז מסירים עד x אלקטרונים ממעטפת האלקטרונים החיצונית של האטום הנייטרלי A. לגבי האניון, מונוטומי Bי- עם מטען y, כמה שיותר אלקטרונים y נלכדים במסלול האנרגיה הנמוך ביותר שעדיין לא מלא.
כיצד לקבוע מספרים קוונטיים
לפני קביעת המספר, עליך לבצע תחילה את תצורת האלקטרונים של היסוד שברצונך למצוא עבורו את הערך הקוונטי. למשל הוא 16ס. תצורת האלקטרונים שלו היא 1 שניות2 2 שניות2 2 עמ'6 3 שניות2 3 עמ'4. לאחר מכן, קח את תצורת האלקטרונים האחרונה, שהיא 3p4.
- בהתבסס על תצורה זו, ערך המספר העיקרי הוא 3, מכיוון שהמספר 3 מייצג את גודל המסלול או הקליפה.
- p היא תת-קליפה של האלקטרון, כך שניתן לקבל אותה תחת הערך של l = 1.
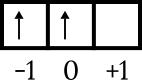
- מכיוון שהוא נמצא בתת-המעטפת p, המספר הקוונטי יהיה בין -1, 0 או +1. בקביעת זה, תחילה צייר את תיבת המסלול. ניתן להשתמש בחצים בעת מילוי הקופסה.
- מלא כל תיבה עם חץ מצביע כלפי מעלה, ולאחר מכן מלא אותה עם חץ מצביע למטה. המספר 4 הוא מספר החצים שיש למלא, כדי שיתקבלו כך.
↑↓ ↑ ↑
-1 0 +1
- החץ הרביעי (האחרון) נמצא בתיבה -1, כאשר הערך המכני הוא m = -1.
- החץ למעלה שווה +1/2, בעוד החץ למטה הוא -1/2. החץ האחרון הוא זה שמצביע למטה, כך שהערך של s = -1/2.
ובכן, כך קובעים את המספר הקוונטי. הנה כמה דוגמאות לשאלות הקשורות לחומר זה שתוכל ללמוד.
לקרוא: שינוי פיזי
דוגמאות למספרים קוונטיים

בדוק את השאלות הבאות!
1. שאלה 1 לדוגמה
קבע את תצורות האלקטרונים ודיאגרמות האלקטרונים של היסודות והיונים המונוטומיים הבאים!
- 8O2-
- 20Mg2+
- 26Fe3+
- 27שיתוף
- 32Ge
פִּתָרוֹן:
- תצורת האלקטרון 8O2:1s2 2 שניות2 2 עמ'4 או [הוא] 2s2 2 עמ'4
תצורת האלקטרון 8O2–: 1 שניות2 2 שניות2 2 עמ'6 או [הוא] 2s2 2 עמ'6 או [Ne] (בתוספת 2 אלקטרונים: 2s2 2 עמ'4+2)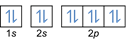
- תצורת האלקטרון 20מג: 1 שניות2 2 שניות2 2 עמ'6 3 שניות2 3 עמ'6 4 שניות2 או [Ar] 4s2
תצורת האלקטרון 20Mg2+: 1 שניות2 2 שניות2 2 עמ'6 3 שניות2 3 עמ'6 או [Ar] (הפחת 2 אלקטרונים מהקליפה החיצונית: 4 שניות2-2)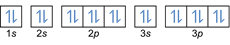
- תצורת האלקטרון 26Fe: 1 שניות2 2 שניות2 2 עמ'6 3 שניות2 3 עמ'6 4 שניות2 3d6 או [Ar] 4s2 3d6
תצורת האלקטרון 26Fe3+: 1 שניות2 2 שניות2 2 עמ'6 3 שניות2 3 עמ'6 3d5 או [Ar]3d5 (החסיר 3 אלקטרונים מהקליפה החיצונית: 4 שניות2-2 3d6-1)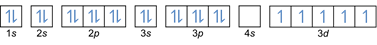
- תצורת האלקטרון 27Co: 1 שניות2 2 שניות2 2 עמ'6 3 שניות2 3 עמ'6 4 שניות2 3d7 או [Ar] 4s2 3d7
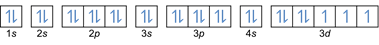
- תצורת האלקטרון 32Ge: 1 שניות2 2 שניות2 2 עמ'6 3 שניות2 3 עמ'6 4 שניות2 3d10 4 עמ'2 או [Ar] 4s2 3d10 4 עמ'2
2. שאלה 2 לדוגמה
לאלקטרון האחרון בגא יש מספר קוונטי...
- n = 4; l = 0
- n = 4; l = 1
- n = 3; l = 2
- n = 4; l = 2
- n = 3; l = 1
פִּתָרוֹן:
אם אתה מסתכל על הטבלה המחזורית הכימית של היסודות, היסוד Ga נמצא בתקופה IV, נותן לו n = 4. גליום נמצא בקבוצה 13, אז האלקטרונים הערכיים נמצאים במעטפת p, כלומר l = 1.
3. שאלה 3 לדוגמה
להלן, המספר הקוונטי שלא ניתן לתפוס על ידי האלקטרון האחרון של אטום Cl, הוא...
- n = 3; l = 1; m = -1; s = -1/2
- n = 3; l = 1; m = 0; s =
- n = 3; l = 2; m = -1; s =
- n = 3; l = 2; m = 1; s = -1/2
- n = 3; l = 1; m = 1; s = 1/2
פִּתָרוֹן:
מכיוון שהיסוד Cl נמצא בתקופה 3, אז n = 3. Cl היא גם קבוצה 17, אז האלקטרונים הערכיים שלה נמצאים בתת המעטפת p, אז l = 1. הערך של m יכול להיות -1, 0 או +1 מכיוון שהאנרגיות של שלושת המספרים הקוונטיים זהים וסדר המילוי אינו משנה.
עבור s יכול להיות גם שווה -1/2 או 1/2, אז אנחנו לא יכולים לקבוע את m ו-s בוודאות.
4. שאלה 4 לדוגמה
אלמנט X3+ בעל תצורת אלקטרונים זהה לאלמנט Ar. אז, היון שיש לו אותה תצורה כמו היון הוא...
- ק+
- Mg2+
- לא+
- Cl+
- ו–
פִּתָרוֹן:
היסוד Ar נמצא בתקופה 3, כך שליון יש אותה תצורת אלקטרונים כמו Ar או [Ne] 3s2 3 עמ'6 יהיה בתקופה 4 עבור קטיונים ובתקופה 3 עבור אניונים. היון המתאים ביותר הוא K+.
5. שאלה 5 לדוגמה
קבע את המספר הקוונטי של היסוד 32גיא!
פִּתָרוֹן:
תצורת האלקטרון 32Ge: 1 שניות2 2 שניות2 2 עמ'6 3 שניות2 3 עמ'6 4 שניות2 3d10 4 עמ'2 או [Ar] 4s2 3d10 4 עמ'2.
התצורה האחרונה היא 4p2. רמת האנרגיה היא 4, ונמצאת בתת-המעטפת p, אז n = 4 ו-l = 1. ציור דיאגרמת מסלול 4p2 לדעת את המספרים האחרים כדלקמן.
האלקטרון האחרון נמצא במסלול התיבה 0, החץ מצביע כלפי מעלה, אז m = 0 ו-s = +1/2.
6. שאלה 6 לדוגמה
כל המספרים הבאים מותרים למספרים קוונטיים, למעט...
- n = 2; l = 1; m = -1
- n = 3; l = 2; m = 1
- n = 3; l = 3; m = -1
- n = 3; l = 0; m = 0
- n = 3; l = 2; m = -1
פִּתָרוֹן:
אם הערך של המספר הראשי (n) הוא 3, אז מספר האזימוט המקסימלי (l) הוא n-1 = 3-1 = 2. לכן, אפשרויות C עם n = 3, l = 3 ו-m = -1 אינן מותרות.
כדי ללמוד מספרים קוונטיים, אתה גם צריך לשלוט בחלק מהמספרים האטומיים של יסודות המשמשים לעתים קרובות או מופיעים בבעיות. בנוסף, כדאי להכיר את סידור רמות האנרגיה בעת בניית תצורות אלקטרונים.
X סגור
פרסומות
פרסומת
X סגור
