מספרי חמצון: הגדרה, כללי קביעה ודוגמאות לבעיות
מספרי חמצון: הגדרה, כללי קביעה ובעיות דוגמא - מהו מספר חמצון ודוגמא? בהזדמנות זו אודות Knowledge.co.id ידון בו וכמובן על דברים אחרים שגם מקיפים אותו.
בואו נסתכל על הדיון במאמר למטה כדי להבין אותו טוב יותר
תוכן עניינים
-
מספרי חמצון: הגדרה, כללי קביעה ובעיות דוגמא
- כללים לקביעת חמצון
- דוגמאות למספרי חמצון
- שתף זאת:
- פוסטים קשורים:
מספרי חמצון: הגדרה, כללי קביעה ובעיות דוגמא
מספר חמצון או מצב חמצון הוא מספר המטענים השליליים והחיוביים באטום, המציין בעקיפין את מספר האלקטרונים שהתקבלו או נמסרו לאטומים אחרים. יש אטומים שיש להם מצב חמצון אחד בלבד, אך יש אטומים שיש יותר ממצב חמצון אחד.
אם אתה מוצא את הערך של מספר אטומי במולקולה או תרכובת, עליך לדעת תחילה את מצב החמצון של האטומים של יסודות אחרים בעלי תכונות כלליות (סטנדרטיות).
כללים לקביעת חמצון
כדי לקבוע את מספר החמצון (Biloks) ביון או בתרכובות אחרות, יש לעקוב אחר הכללים הבאים:
-
למצב החמצון של יסוד חופשי בצורת אטום או מולקולה של יסוד ערך 0 (אפס).
היסודות החופשיים בצורת אטומים הם:
- מצב החמצון של C ב- C הוא = 0
- מצב החמצון של Ca ב- Ca הוא = 0
- מצב החמצון של Cu ב- Cu הוא = 0
- מצב החמצון של Na ב- Na הוא = 0
- מצב החמצון של Fe ב- Fe הוא = 0
- מספר החמצון של Al ב- Al הוא = 0
- מצב החמצון של Ne ב- Ne שווה ל- 0
היסודות החופשיים בצורת מולקולות הם:
- מצב חמצון H של H2 הוא = 0
- מצב החמצון של O ב- O2 הוא = 0
- מצב החמצון של Cl ב- Cl2 הוא = 0
- מצב החמצון של P ב- P4 הוא = 0
- מצב החמצון S ב- S8 הוא = 0
-
מצב החמצון של מתכת בתרכובת הוא תמיד חיובי.
בקבוצה 1 אלמנטים מתכתיים (מערכת ישנה גול. IA) (Li, Na, K, Rb, Cs, Fr), מצב החמצון שלה הוא +1.
- מצב החמצון של K ב- KCl, KNO3 או K2SO4 הוא = +1
בקבוצת 2 אלמנטים מתכתיים (קבוצת מערכת ישנה. IIA) (Be, Mg, Ca, Sr, Ba, Ra), מצב החמצון שלה הוא +2.
- מצב החמצון של Mg ב- MgO, MgCl2 או MgSO4 הוא = +2
מספרי החמצון (Biloks) של יסודות מתכת אחרים הם:
- Ag שווה = +1
- Cu שווה = +1 ו- +2
- Hg שווה = +1 ו- +2
- Au שווה = +1 ו- +3
- Fe שווה = +2 ו- +3
-
מספר החמצון (Bilox) של יוני מונו-אטומי (לאטום 1) ופולי-אטומי (יותר מ -1 אטום) זהה במטען של היונים.
-
מצבי החמצון של יונים מונטומיים הם Na +, Ca2 +, Al3 +, Cl– ו- 02- בהתאמה + 1, + 2, +3, -1 ו- -2.
- מצבי החמצון של יונים פולי-אטומיים הם NH4 +, SO42-, PO43-, בהתאמה +1, -2 ו- -3.
-
-
מספר החמצון של יסודות VIA בקבוצה (O, S, Se, Te, Po) בתרכובות בינאריות הוא -2, ורכיבי VIIA בקבוצה (F, Cl, Br, I, At) בתרכובות בינאריות הוא -1.
-
מצב החמצון של היסוד S ב- Na2S וב- MgS הוא = -2.
- מצב החמצון של היסוד Cl ב- NaCl, KCl, MgCl2 ו- FeCl3 הוא = -1.
-
-
מספר החמצון של יסוד H בתרכובותיו הוא = +1.
למעט מצב החמצון של הידרידים (תרכובות מימן עם מתכות) הערך = -1.
מכיוון שבהידרידים, מימן קיים בצורה של יון ההידריד, H–. מצב החמצון של יון כמו הידריד זהה למטען על יון, שהוא = -1.
- מצב החמצון של היסוד H ב- H2O, HCl, H2S ו- NH3 הוא = +1.
- מספר החמצון של יסוד H ב- NaH, CaH2 ו- AlH3 הוא = -1.
-
מספר החמצון של היסוד O במתחם שלו הוא -2, למעט,
-
מספר החמצון של תרכובת בינארית ב- F הוא = +2.
- מצב החמצון של תרכובות פרוקסיד, כמו H2O2, Na2O2 ו- BaO2, הוא = -1.
- מצב החמצון של תרכובות סופר-חמצניות, כגון KO2 ו- NaO2, הוא = -½.
- מספר החמצון (Biloks) של יסוד O ב- H2O, KOH, H2SO4 ו- Na3PO4 הוא = -2
-
-
סכום מספרי החמצון של היסודות בתרכובת הוא 0 (אפס).
סכום מספר החמצון של יסודות היוצרים יונים או תרכובות פוליאטומיות שווה למטען על היון הפוליאטומי עצמו.
-
מספר החמצון של חמצן (O) בתרכובת החמצן = -1. מספר החמצון של O בתרכובות שאינן חמצן = -2.
דוגמא:
מצב חמצון ב- BaO2 = -1.
אטום ה- Ba הוא יסוד מתכת קבוצתי IIA, כך שמצב החמצון של Ba = +2. סכום מצבי החמצון של Ba ו- O חייב להיות 0 (כלל החמצון נקודה 6). לכן, מצב החמצון של O חייב להיות -2. מכיוון שלאטום O יש אינדקס 2, אז מצב החמצון O: אינדקס O = -2: 2 = -1. הוכח שמצב החמצון של O ב- BaO2 הוא -1.
דוגמאות למספרי חמצון
דוגמא לשאלה 1
קבע את מספר החמצון של היסודות המודגשים בתרכובות הבאות:
- נ2או5
- MnO4–
- אל2(כך4)3
תשובה:
מצב החמצון ייקבע, למשל x:
- 1. תשלום N2או5 כלומר (2 x מצב חמצון של N) + (5 x חמצון של O)
0 = (2x (x)) + (5 x (-2))
0 = 2x - 10
x = +5
אז מספר החמצון של האטום N במתחם N2O5 הוא +5
- 2. תשלום MnO4– הוא (1 x מספר חמצון של Mn) + (4 x מצב חמצון של O) כדלקמן!
-1 הוא (1 x (x)) + (4 x (-2))
-1 הוא x - 8
x הוא +7
אז מספר החמצון של אטום Mn בתרכובת MnO. הוא4– כלומר +7
- 3. עומס2(כך4)3 = (2 x מצב חמצון של Al) + (3 x מצב חמצון של S) + (12 x חמצון של O), הוא:
0 = (2 x (+3)) + (3 x (x)) + (12 x (-2))
0 = 6 + 3x -24
x = +6
אז מספר החמצון של אטום ה- S בתרכובת Al הוא2(כך4)3 כלומר +6.
דוגמא לשאלה 2
מיד לבעיה לדוגמא במספרי חמצון, שב- 'מהו מספר החמצון של אטום C במספר החמצון ב- CH4 עם כלל מספר החמצון H = +1?
תשובה:
Oxx של H x מספר האטומים H = + '1 x 4 = +4
Oxx C x מספר האטומים C = a x 1 = a
אם הצפייה מהמתחם היא תרכובת ניטרלית, אז מספר מצבי החמצון של היסודות בה חייב להיות אפס, כלומר:
a + (+4) = O
a = -4
אז מספר החמצון של C במתחם CH4 הוא -4.
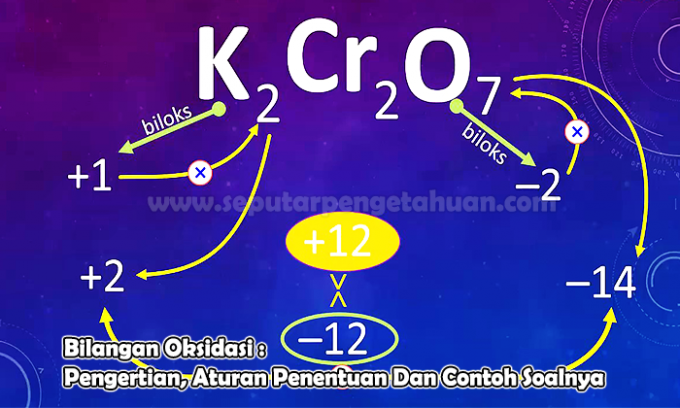
דוגמא לשאלה 3
קבע את מספר החמצון של היסוד N בתרכובות הבאות:
נ2או5
תשובה:
מצב החמצון יסומן ב- X
תשלום N2או5 כלומר (2 x מצב חמצון של N) + (5 x חמצון של O)
0 = (2 x (x)) + (5 x (-2))
0 = 2x - 10
x = +5
אז מספר החמצון של האטום N בתרכובת N הוא2או5 כלומר +5.
זו הסקירה מאת אודות Knowledge.co.id על אודות מספרי חמצון: הגדרה, כללי קביעה ובעיות דוגמא, אני מקווה שזה יכול להוסיף לתובנה והידע שלך. תודה שביקרת ואל תשכח לקרוא מאמרים אחרים.
קרא גם:BMKG: הגדרה, היסטוריה, תפקיד ופעילויות
