Redoks Reaksiyon Malzemesi: Kavramlar, Denkleştirmeler, Örnekler
Yükleniyor...
Lisedeyken sıkça duyabileceğimiz redoks reaksiyonları örnekleri. Redoks reaksiyonu, indirgeme ve oksidasyon reaksiyonlarının bir kombinasyonu nedeniyle oluşan kimyasal bir reaksiyondur. Bu nedenle terim redoks (indirgeme-oksidasyon) olur.
Bu reaksiyon, atomlardan oksidasyon sayısı veya oksidasyon durumundaki değişikliklere kadar tüm kimyasal süreçleri içerir. Tam bir kimyasal reaksiyonda, bu oksidasyon reaksiyonunu her zaman bir indirgeme reaksiyonu takip eder, bu nedenle redoks reaksiyonu olarak bilinir.
İçindekiler listesi
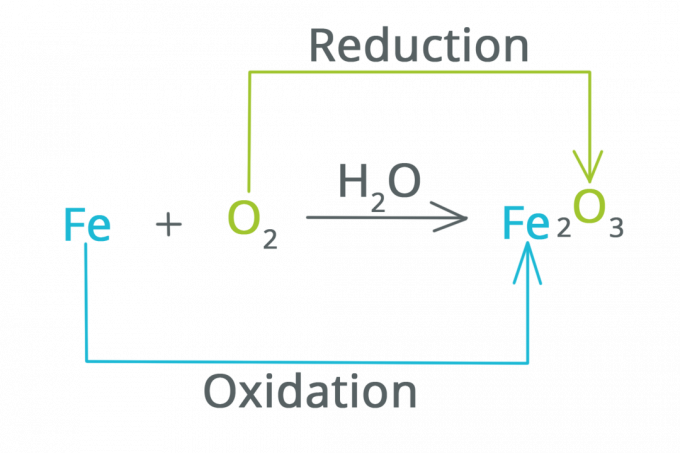
İndirgeme ve Oksidasyon

Daha önce bahsedildiği gibi, redoks reaksiyonları, bir elektrokimyasal süreç meydana geldiğinde meydana gelen indirgeme ve oksidasyon reaksiyonlarının bir kısaltmasıdır.
İndirgenme, oksidasyon sayısının azaldığı ve elektronların arttığı bir reaksiyondur. İndirgemenin, bir maddenin oksijen kaybetmesine neden olan bir reaksiyon olduğu söylenebilir.
Oksidasyon, oksidasyon sayısının arttığı ve elektronların azaldığı bir reaksiyondur. Oksidasyonun, bir maddenin oksijene bağlandığı bir reaksiyon olduğu söylenebilir.
Okumak: Sıvı
Oksidasyon Numarası (Oilox)

Elektron transferini içeren bir redoks reaksiyonu kavramı, yalnızca iyonik bileşiklerde meydana gelebilirken, kovalent bileşikler için böyle değildir. Bu nedenle, oksidasyon sayılarındaki değişikliklere dayanan üçüncü bir redoks kavramı ortaya çıktı.
Oksidasyon sayısı, bir atom üzerindeki pozitif ve negatif yüktür. Pozitif oksidasyon durumuna sahip elementler genellikle metalik elementlere sahip atomlardır, negatif oksidasyon durumuna sahip elementler için ise genellikle metal olmayan atomlar kullanılır.
Oksidasyon numarasını değiştirme kavramına dayanarak, bu sayıyı belirlemek için sekiz kural vardır, yani:
- Atomik ve moleküler şekilli serbest elementlerin oksidasyon sayısı 0'dır.
- İyon üzerindeki yük türüne göre tek atomlu ve çok atomlu iyonların oksidasyon sayısı
- IA, IIA, IIIA gruplarındaki elementlerin ait oldukları gruba göre oksidasyon sayıları
- Geçiş grubu elementlerinin oksidasyon sayısı birden fazladır.
- Bir iyonu oluşturan elementlerin yükseltgenme sayılarının toplamı = sahip olduğu yük miktarı
- Bir metale bağlandığında hidrojenin oksidasyon sayısı = -1 iken, H bir metal olmayana bağlandığında +1'dir.
- Peroksit bileşiklerindeki oksijen sayısı = -1, peroksit olmayan bileşiklerdeki O oksidasyon sayısı = -2
Azaltma ve Oksitleme

Redoks reaksiyonlarının örneklerini tartışmadan önce, önce indirgeyici ajanları ve oksitleyici ajanları bilmek asla zarar vermez. Bir oksidasyon reaksiyonu ve oksidasyon sayısındaki bir değişikliğin eşlik ettiği bir indirgeme içeren bir reaksiyonda.
Oksitleyici maddeler, diğer maddeleri veya reaksiyona girdiklerinde indirgenen maddeleri oksitleyebilen maddelerdir. İndirgeyici ajan, reaksiyona girdiğinde oksidasyona uğrayan diğer maddeleri veya maddeleri azaltabilen bir maddedir.
Okumak: Sağlam
Redoks Reaksiyon Özellikleri
Redoks reaksiyonları örneklerine ek olarak, bilmemiz gereken diğer şeyler, bu reaksiyonun özellikleri, diğerlerinin yanı sıra aşağıdaki özelliklerdir:
- İndirgeyici ajanlar ve oksitleyici ajanlar vardır
- Oksidasyon durumunda bir değişiklik var
- Klor, oksijen, cuprum ve diğerleri gibi serbest elementler vardır.
Redoks Reaksiyon Fonksiyonu

Günlük yaşamda redoks reaksiyonlarının çeşitli işlevleri vardır, yani:
- Metal korozyon sürecini ve nasıl önleneceğini anlamak için
- Kanalizasyon arıtma olarak aktif çamur uygulaması
- Bitki fotosentez süreci
- Hücrelerdeki besinlerin oksidasyonunu görmek
- Cıvata ve somunlara çinko kaplama yapılır, bu katmanda çinko oksidasyon işlemi ve katyon indirgeme vardır.
- Paslanmaz çelikten mutfak eşyaları yapmak, böylece paslanmazlar
- Endüstriyel ihtiyaçlar için sülfürik asit yapmak ve cevher işlemek.
Redoks Reaksiyon Denkleştirme

Aslında bu redoks reaksiyonu sulu çözücülerde meydana gelir, dolayısıyla sahip olduğu denklem H+ ve OH- iyonlarını içerecektir. Oksidasyon sayıları ve yarı reaksiyonlar yoluyla bunu öğretmek için kullanılan 2 yöntem vardır.
Redoks reaksiyonlarının dengelenmesi, hem moleküler hem de iyonik reaksiyonlardaki oksidasyon sayıları veya oksidasyon durumları dengelenerek yapılabilir. Bu oksidasyon yöntemi, “Tüm e-oksitlenmişlerin toplamı, toplam e-indirgenmiş miktarına eşittir” ilkesine dayanmaktadır.
Günlük Yaşamda Redoks Reaksiyonları Örnekleri

Redoks reaksiyonu problemlerinin örneklerinde, genellikle günlük hayatta redoks reaksiyonlarından bahsedecek sorular buluruz. Aşağıdakiler, günlük yaşamdaki redoks reaksiyonlarının örnekleridir, yani:
1. çamaşır suyu
Çamaşır suyu, nesnelerden rengi kaldırabilen bir bileşiktir. Örneğin, tekstil. Ağartıcının neden olduğu renk kaybı, oksidasyon reaksiyonundan kaynaklanır.
Ağartma maddelerinde sıklıkla kullanılan oksitleyici maddeler hidrojen peroksit ve sodyum hipoklorittir.
2. Bitki Fotosentez Süreci
Fotosentez, doğal bir biyolojik oksidasyon-redüksiyon reaksiyonu sürecidir. Fotosentezin kendisi çok karmaşık bir süreçtir.
Fotosentez sürecinden gelen organizmalar, redoks reaksiyonlarından şeker ve oksijen üretmek için güneş ışığındaki enerjiyi kullanabilirler.
3. Propan Yakma
Diğer bir örnek ise yanmadır. Propan yanmasında, hava O2 içerirken, karbon atomları oksitlenecek ve CO2 oluşturacak, oksijen ise H2O olacaktır.
Okumak: Gaz Maddesi
Redoks Reaksiyonu Problemlerine Örnekler

Reklamcılık
1. SO bileşiğindeki elementin oksidasyon durumunu belirleyin42- ve NaNO3
Cevap:
BÖYLE42– = çok atomlu iyon
Çok atomlu iyonun Oxx = toplam yük = -2
Bileşikte Oxox = -2
S+4 bloğu. oksidasyon durumu = -2
-6 + 4. (-2) = -2
Böylece, S = -6 oksidasyon sayısı ve O = -2 oksidasyon sayısı.
NaNO3 = yüksüz bileşik
Toplam oksidasyon durumu = 0
Bileşikte Oxox = -2
Na'nın Oxx'i (metal) = değerlik elektronlarının sayısı = +1
Oksidasyon durumu Na + oksidasyon numarası N + 3'tür. oksidasyon durumu = 0
+1 + (+5) + 3. (-2) = 0
Böylece, Na = +1'in oksidasyon durumu, N = +5'in oksidasyon durumu ve O = -2'nin oksidasyon durumu
2. Aşağıdakilerden hangisi oksitleyici ajan, indirgeyici ajan, indirgeyici ajan ve aşağıdaki kimyasal reaksiyonun ürünüdür.
Fe + HCl → FeCl3 + H2
Cevap:
Oksitleyici madde (indirgenmiş) = HCl
İndirgeyici madde (oksidasyon yaşayan) = Fe
Oksidasyon ürünü = FeCl3
Azaltma sonucu = H2
3. Aşağıdaki redoks denklemlerini dengeleyin
Bi2Ö3 + ClO– → 2BiO3– + Cl– (dil atmosferi).
Cevap:
oksidasyon numarası nasıl
Eşitlenmiş sol ve sağ şarj: 2OH– + Bi2Ö3 + ClO– → 2BiO3– + Cl–
Aynı sayıda atom: 2OH– + Bi2Ö3 + 2ClO– → 2BiO3– + 2Cl– + H2Ö
Yani Eşdeğer Reaksiyon: 2OH– + Bi2Ö3 + 2ClO– → 2BiO3– + 2Cl– + H2Ö
Yarım Reaksiyon Yolu
Redoks: Bi2Ö3 + 2ClO– → 2BiO3– + 2Cl–
OH ekleyerek yükü dengeleyin– (temel).
2OH– + Bi2Ö3 + 2ClO– → 2BiO3– + 2Cl–
H ekleyerek atom sayısını dengeleyin2Ö.
2OH– + Bi2Ö3 + 2ClO– → 2BiO3– + 2Cl– + H2Ö
Yani Eşdeğer Reaksiyon: 2OH– + Bi2Ö3 + 2ClO– → 2BiO3– + 2Cl– + H2Ö
Redoks reaksiyonlarının örneklerini incelemek ve hatta bunların tam olarak tartışılması kolay değildir, ayrıca bu materyalde ezberlenmesi gereken çok sayıda bileşik vardır. Bu nedenle, onu iyi anlamak için pratik yapmaya devam etmekten çekinmeyin.
REKLAMCILIK
X KAPAT
