Faraday Yasası Materyali: Sesler, Formüller, Örnek Problemler
Yükleniyor...
Faraday Yasasının ne olduğunu biliyor musunuz? Elektromanyetizma ile ilgili yasalardan biridir ve elektrik devreleri ile manyetik alanlar arasındaki etkileşimlerin elektromotor kuvvetleri üretebilmeleri için tahminler sağlar.
1833 yılında İngiliz bilim adamı Michael Faraday tarafından keşfedilmiş, bugüne kadar hala kullanılmaktadır ve bazı alanlarda çok faydalıdır. Ne anlama geldiğini ve sorunun bir örneğini bilmek ister misiniz?
İçindekiler listesi
Faraday'ın 1. Yasası

İki Faraday Yasası vardır, ilki elektroliz ve elektrik yükü süreciyle ilgilidir.
"Elektroliz işlemi sırasında bir elektrottan üretilen maddenin kütlesi, kullanılan elektrik yükünün miktarı ile doğru orantılı olacaktır" yazıyor.
Kullanılan denklemler:
WQ
W = bir maddenin kütlesi
Q = elektronların elektrik yükü
Kullanım alanları şunlardır:
S = ben x t
i = elektrik akımı (amper cinsinden)
t = zaman (saniye cinsinden)
Elektrik yüklerinin kullanımının toplamının açıklanmasıyla sonuç, akım gücünün zamanla çarpımına eşit olacaktır.
Ayrıca, yukarıdaki yasanın kullanımının sonuçlarından daha fazla benzerlik vardır:
w ben x ta
Başvurusunda kullanılan formüle gelince:
W = e.i.t/F
Bilgi:
W = bir elektroliz işleminde üretilen bir maddenin kütlesi (gram olarak)
e = eşdeğer kütle
i = akım gücü (amper cinsinden)
t = zaman (saniye cinsinden)
F = Faraday'ın kesin sayısı 96.500 Coulomb/mol ile belirlenmesi.
Faraday yasasının kimya dünyasındaki uygulaması, elektrik akımı ve elektroliz ile ilgili çeşitli bileşenler aracılığıyla görülebilir.
Mekanik kaynaklardan elektrik enerjisi üretme ve elektromanyetik indüksiyon kullanma işlevine sahip özel bir cihaz olan elektrik jeneratöründe olduğu gibi. Jeneratörlerin iki türü vardır, yani akım ileri geri ve doğrudan akar.
Bir sonraki uygulama, alternatif akım ve doğru akım olmak üzere iki tipi olan bir dinamodur.
Okumak: Kirchhoff Yasası
Faraday'ın 2. Yasası

Faraday'ın 1. Yasası'nın aksine, "Cismin ürettiği maddenin kütlesi" sesiyle bir saniye daha vardır. elektroliz işlemi sırasında bir elektrot, maddenin eşdeğer kütlesi ile doğru orantılı olacaktır. .
Bir maddenin kütlesi ile kastedilen şey, kanunun uygulanmasında olan bir maddenin kütlesidir. O halde eşdeğer kütle, stokiyometrik olarak 1 mol elektronla aynı sayıda mol içeren bir maddenin kütlesidir.
Denklem:
Maddenin kütlesi Maddenin kütle eşdeğeri
ben
ME = iyon/Ar'ın oksidasyon durumu veya yükü
Bu ikinci yasanın uygulanmasında kullanılan formül:
W1/W2 = e1/e2
Bilgi:
W1 = birinci maddenin kütlesi (gram olarak)
W2 = ikinci maddenin kütlesi (gram olarak)
e1 = birinci maddenin eşdeğer kütlesi
e2 = ikinci maddenin eşdeğer kütlesi
Bu ikinci yasanın uygulanmasında eşdeğer kütle fonksiyonu çok önemlidir. Bir elektroliz reaksiyonunda meydana gelen oksidasyon sayısındaki değişime bölünür.
Denklem:
Mmeşe = Ar
Oksidasyon sayısında değişiklik
Temel stokiyometrik kavramlardan bahsederken, kütle, mo sayısı ve moların kütlesi arasında Faraday'ın 1. ve 2. yasalarının birleşik kullanımıyla yakından ilgili olacak bir ilişki vardır.
Denklem:
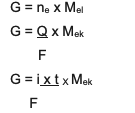
Özet, ve 2 arasındaki birleşik denklemdir, yani:
Reklamcılık
G ~ ben x t x Mmeşe
Bilgi:
G = ürünün kütlesi (gram olarak)
Q = elektrik yükü (Coulomb birimlerinde)
i = elektrik akımının gücü (amper cinsinden)
t = zaman (saniye cinsinden)
Mmeşe= maddenin eşdeğer kütlesi (gram/mol olarak)
F = 96.500 coulomb/mol olan Faraday sabiti)
Okumak: Hook kanunu
Faraday Yasası Problemi Örneği
Faraday Yasasının uygulamasını daha iyi anlamak için, uygulamasına ilişkin bazı örnekler aşağıda verilmiştir.
1. örnek 1
Bir elektrik devresinde 5 gram büyüklüğünde bir Cu birikimi olmuştur. Elektrotlarda hangi Ag kütlesi çöktü? Ek bilgi için Ag = 108 ve Cu = 63,5.
Ag veya W'nin kütlesini bulmak için formül içinAg aşağıdaki formülü kullanabilirsiniz:
WCu = BENCu
WAg= BENAg
ME denklemi ile bilinir = Ar
Oksidasyon Sayısı = 2
Bilinen:
WCu = 5 gram
İlk önce, hem Cu hem de Ag'nin indirgeme reaksiyonlarını aşağıdaki gibi kullanarak iki maddenin ME'sini hesaplayın:
Cu2+ + 2e– → Cu(lar), MEku
= birr = 63,5
Oksidasyon sayısı =2
= 31,75
Ag+ + e– → Ag(ler) MEAg
= birr = 108
Oksidasyon sayısı = 1
= 108
sonraki 5gCu = 31.75
WAg 108
= 17
Yani yerleşen Ag'nin kütlesi = 17 gramdır.
2. Örnek 2
Ca iyonlarını azaltmak için kaç Faraday gerekir?2+ 12 gram miktarı ile? İşte tartışma:
CA2+→ değerlik 2'dir
Ca'nın Ar'ı 40'tır
Kullanılan formül W = e x F'dir
F = W/e nerede bulunur
Cevap:
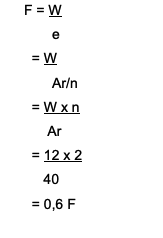
Yani Ca iyonlarını azaltmak için 0.6 Faraday gerekir.2+ yani 12 gram.
Okumak: Coulomb yasası
3. Örnek 3
0,2 amperlik bir elektrik akımının 50 dakikalık bir süre boyunca akmasına izin verilir, ardından bir CuCl çözeltisi içeren elektroliz hücresine girer.2. Katotta oluşacak Cu çökeltisinin miktarı nedir? Ek bilgi olarak Cu = 63.5'ten Ar
Bilinen:
I = 0,2 amper sembollü akım
t = 50 dakika sembollü süre, saniye olarak kullanılırsa 50 x 60 saniyedir, yani 3.000 saniyedir
sorulan:Cu?
Cevap: Önce Cu indirgeme reaksiyonunu yazın, yani:
Cu2+ (sulu) + 2e+ → Cu(lar)
BENCu = Ar
Oksidasyon sayısı = 63.5/2
= 31,75
W'yi bulmak için kullanılan formülku dır-dir:
Wku = (1/96.500) x ben x t x MEku
= (1/96.500) x 0,2 A x 3000 sn x 31,75
= 0.197 gram
Böylece oluşan Cu birikiminin değeri 0.197 gramdır.
4. Örnek 4
Karbon tipi elektrot ile yapılan bir elektrolizde, 12.7 gram miktarında Cu tipi bir çökelti üretebildi. 4 amperlik bir elektrik akımı kullanır. Elektroliz ne kadar sürer?
Bilinen:
Cu'nun Ar'ı = 63,5
Sorulan: W?
Cevap:

Dolayısıyla, Faraday yasasından geçerli olan formül kullanılarak elektroliz süresi 9.650 saniyedir.
Kimya okuyanlarınız için elbette Faraday yasasını doğru bir şekilde anlamanız gerekecek. Böylece yasanın uygulanması ile ilgili bir görev verildiğinde, mevcut formülleri kullanarak doğru ve eksiksiz olarak cevaplayabilirsiniz.
X KAPAT
Reklamlar
REKLAMCILIK
X KAPAT
