ISI: Formüller, Tipler, Örnek Problemler (Özet)
Yükleniyor...
Isı formülü, Fizik derslerinde çok tanıdık bir şeydir. Isı, bir nesne tarafından alınabilen veya salınabilen bir enerji şeklidir. Isı, joule veya kalori adı verilen birimlere sahiptir.
Isı, belirli maddelerin sahip olduğu ısı enerjisi olarak yorumlanabilir ve cismin sıcaklığı ölçülerek tespit edilebilir. Açık bırakılan ılık suya ısı uygulamasını görebilirsiniz, sudan havaya ısı salındığı için yavaş yavaş soğur (artık ısınmaz).
İçindekiler listesi
Kalori Tanımı

Isı, sıcaklığı yüksek olan bir nesneden sıcaklığı daha düşük olan bir nesneye, iki nesne birbirine dokunduğunda veya bir araya getirildiğinde geçebilen bir enerjidir. Farklı sıcaklıklara sahip iki nesne, ısının akmasına ve hareket etmesine neden olur.
Örneğin, sıcak su ile soğuk suyu karıştırdığınızda, birleşen su ılık su olur. Ayrıca sıcaklık ve ısının iki farklı şey olduğunu anlamalısınız. Sıcaklık, termometre ile ölçülebilen bir değer iken, ısı akan enerjidir.
Uluslararası Sisteme (SI) veya MKS'ye göre ısı birimi Joule (J), CGS'ye göre ısı birimi erg'dir. Bir dizi yiyecek türü için ısı, kalori birimini kullanır.
Bir kalori, 1 gram suyun sıcaklığını 1 santigrat dereceye çıkarmak için gereken ısı enerjisi miktarı olarak tanımlanır. Dolayısıyla, 1 kalori = 4,184 Joule olduğu veya genel olarak doğrudan 4,2 J'ye yuvarlandığı sonucuna varılabilir.
Kalori Formülü
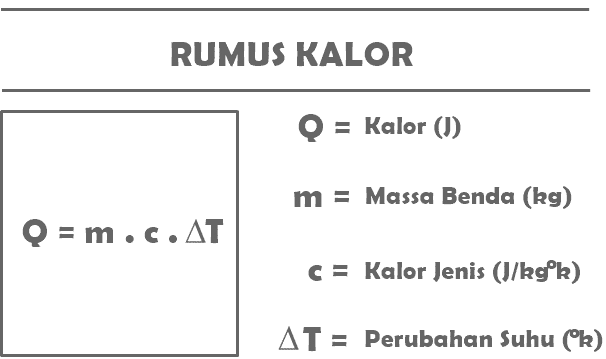
Yukarıda okuduğunuz ısı tanımına göre Fizik konularında ısı maddesi ile ilgili özetlenmiş formüllerden bazıları aşağıdadır.
1. Isı Transfer Formülü
S = m. c. T
İle birlikte:
Q = belirli bir nesne tarafından alınan veya salınan ısı miktarı (J)
m = ısı alan veya serbest bırakan nesnenin kütlesi (kg)
c = maddenin özgül ısısı (J/kg°C)
T = sıcaklıktaki değişiklik (°C)
2. Özgül Isı Formülü
Bu formülün ölçütü, her zamanki gibi matematiksel olarak hesaplanacak olan c (maddenin özgül ısısı) elementini çıkararak ısı transferi formülüdür.
c = Q / (m. T)
İle birlikte:
c = maddenin özgül ısısı (J/kg°C)
Q = belirli bir nesne tarafından alınan veya salınan ısı miktarı (J)
m = ısı alan veya serbest bırakan nesnenin kütlesi (kg)
T = sıcaklıktaki değişiklik (°C)
3. Isı Kapasitesi Formülü
C = Q / T
İle birlikte:
C = ısı kapasitesi (J/°K)
Q = çok fazla ısı (J)
T = sıcaklıktaki değişim (Kelvin / K)
4. Isı Kapasitesini Belirleme Formülü
C = m. c
İle birlikte:
C = ısı kapasitesi (J/°K)
m = ısı alan veya serbest bırakan nesnenin kütlesi (kg)
c = maddenin özgül ısısı (J/kg°K)
5. Erime Isısı ve Buhar Formülü
Füzyon ısısının formülü aşağıdaki gibidir.
S = m. L
Buharın ısısının formülü aşağıdaki gibidir.
S = m. sen
İle birlikte:
Q = çok fazla ısı (J)
m = nesnenin kütlesi (kg)
L = füzyon ısısı (J/kg)
U = maddenin buhar ısısı (J/kg)
Okumak: Termodinamik
Kalori Türleri

Belirli bir maddedeki iş sürecine göre ayırt edilen çeşitli ısı türleri vardır. Aşağıda, günlük yaşamdaki uygulamasını görebilmeniz için anlamanız gereken ısı türleri bulunmaktadır.
1. Oluşum Isısı (ΔHf)
Oluşum ısısı, moleküler formül kullanılarak yazılan gazlar gibi elementlerinde bir bileşiğin 1 molünü oluşturmak için üretilen veya gerekli olan ısıdır. Bazı oluşum ısısı örnekleri C'dir.12, Ö2, Br2, H2.
2. Ayrışma Isısı (ΔHd)
Bozunma ısısı, 1 mol bileşiği başka bir elemente parçalamak için üretilen veya gerekli olan ısı şeklidir.
3. Yanma Isısı (ΔHc)
Yanma ısısı, bir element veya bileşiği gibi bir maddenin 1 molünü yakmak için kazanılan veya gerekli olan ısıdır.
4. Nötralizasyon Isısı (ΔHn)
Nötralizasyon ısısı, bir mol H oluşturmak için elde edilen veya gereken ısı türüdür.2Bir asit ve bir baz arasındaki reaksiyondan O. Bu ısı ekzotermik bir reaksiyondur çünkü sıcaklıkta bir artış olur.
5. Çözünme Isısı (ΔHs)
Çözünme ısısı, başlangıçta katı olan 1 mol maddenin bir çözelti içinde çözülmesi için üretilen veya gereken ısı türüdür.
Okumak: Yoğunluk Formülü
Özgül Isı ve Isı Kapasitesi
Ayrıca, farklı madde parçacıklarına ve farklı sıcaklık değişimlerine sahip iki maddede ısının akabileceğini bilmeniz gerekir. Örneğin, su ve yağ aynı sıcaklığa ısıtıldığında, yağın sıcaklığı suyun sıcaklığından daha fazla değişir.
Bu, bir araya getirilen veya bir araya getirilen iki nesnede farklı ısı türleri olduğu için olabilir. Özgül ısı, sıcaklığı 1 kg kütleden 1°C'ye çıkarmak için gereken ısı miktarıdır, birimi kalori/gram°Celcius veya J/kg°C'dir.
Her maddenin kendine özgü bir ısısı vardır ve bunda farklılıklar vardır. Bu arada, ısı kapasitesi kavramı, bir cismin sıcaklığını 1°C'ye yükseltmek için gereken veya emilen ısı miktarıdır.
Isı Değişimi
Uygulamasında ısı formülü, bir araya getirilen veya birbiriyle temas eden iki maddeyi değiştirme prensibi ile çalışır. Aşağıda, bir araya getirilen veya bir araya getirilen maddeler olduğunda meydana gelen bir ısı değişimi verilmiştir.
1. Isı Bir Maddenin Sıcaklığını Değiştirebilir
Her temel nesne, mutlak sıfırdan daha düşük bir sıcaklığa sahiptir, bu nedenle nesnenin ısısı olmalıdır. Bu içerik daha sonra nesnenin sıcaklığının ne kadar ısıya sahip olduğunu belirleyecektir.
Nesne ısıtıldığında, ek ısı alır. Sıcaklık da artacak veya artacaktır. Tersine, nesne soğutulursa, ısı açığa çıkar ve sıcaklıkta bir düşüşe neden olur.
2. Isı Maddeleri Değiştirebilir

Bazı nesne türlerinde, belirli birimlerde ısı verildiğinde, nesne hal değişikliğine uğrayabilir. Örneğin, buza ısı verilirse (ısıtılırsa), buz katıdan sıvıya ve hatta gaza dönüşür.
Isıtma işlemi sürekli olarak yapılırsa, suyun tekrar maddeye dönüşmesine neden olan şey budur. Bu, form değiştirmek üzere olan nesne, sıvı noktasından nesnenin erime noktasına hareket ettiğinde olur.
Isı Transferi Türleri
Isının tanımı, türleri, formülleri, ısıdaki değişimler hakkında bir açıklama yaptıktan sonra, ısının başka nesnelerle karşılaştığında veya onlarla temas ettiğinde de hareket edebileceği sonucuna varabilirsiniz. Aşağıdakiler bazı ısı transferi türleridir.
1. iletim

İletim yoluyla ısı transferi, metal gibi bir ara maddeden geçerken meydana gelir, ancak bunu maddedeki parçacıkların kalıcı bir hareketi takip etmez. Örneğin bir metalin bir ucunu ısıttığınızda diğer ucu da ısınır.
Bunun nedeni, ısının yüksek sıcaklıktan düşük sıcaklığa iletilmesidir. Isıtılmış metal uç, metal parçacıkların kendilerine bağlı diğer parçacıklarda titreşim oluşturmasına neden olacaktır.
Bu nedenle, metalin sadece bir ucu ısıtılsa bile tüm metal parçacıkları titreşir ve bu da ısı transferine neden olur. Diğer bir örnek, motor çalıştırıldığında motosiklet egzozunun sıcak olmasıdır.
İletim ayrıca havai fişekleri ateşe tuttuğunuzda, pişirme işlemi sırasında ısınan bir tencerenin kapağını tuttuğunuzda, ısıtıldığında eriyen tereyağı vb. İletim için ısı transferi formülü aşağıdaki gibidir.
Isı Hızı = Q/t = kA. T / x
2. Konveksiyon
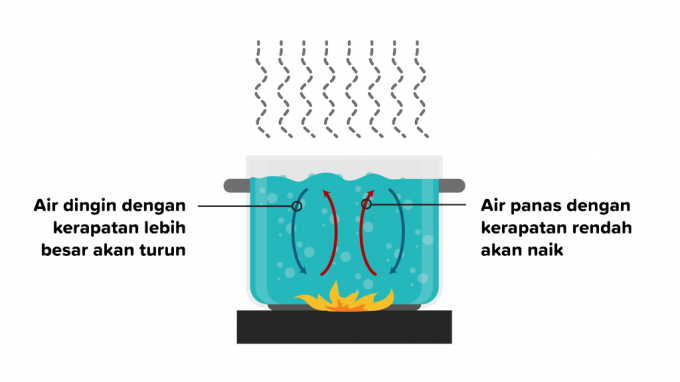
Konveksiyon, ısının bir maddeden geçtiği ve ardından maddenin parçalarının hareketinin takip ettiği ısı transferidir. Konveksiyonla ısı transferi sıvılarda veya gazlarda gerçekleşebilir, bu nedenle konveksiyon aşağıdaki gibi ikiye ayrılır.
a. Bilimsel Konveksiyon
Konveksiyon, dış etkenler olmaksızın kaldırma kuvveti nedeniyle oluşan ve farklı nesne türlerinden etkilenen bir ısı transferidir. Örnek bir durum, suyu ısıtırken, sıcak su parçacıklarının yoğunluğunun ateşten uzaklaşacağı, ardından daha düşük sıcaklıktaki bir su maddesinin onun yerini alacağıdır.
b. Zorlanmış Konveksiyon
Reklamcılık
Konveksiyon, basınç gibi dış faktörlerin etkisinin neden olduğu, dolayısıyla transferin kasıtlı veya zorla gerçekleşmesiyle oluşan bir ısı transferidir. Yani ısı yardımı nedeniyle bir yere taşınmak zorunda kalır.
Sıcak hissettiren bir yere soğuk hava üreten bir fanın, araba radyatöründeki motor soğutma sisteminin vb.
Başka bir konveksiyon uygulaması, suyun yukarı ve aşağı hareketinin olduğu suyu ısıtırken ortaya çıkar, yeşil fasulye tohumları kaynatıldığında yükselen ve düşen, kara ve deniz meltemlerinin süreci, sıcak hava balonlarının hareketi, baca dumanı fabrika.
Konveksiyonla ısı transferi formülü aşağıdaki gibidir.
Isı Hızı = Q/t = hA. T
3. Radyasyon

Radyasyon, bir ara madde veya ortam gerektirmeyen ısı transferidir. Radyasyondaki ısı transferi, iletim ve konveksiyon ile aynı şey değildir. Radyasyondaki yer değiştirme, iki maddeyi her zaman temas ettirmez veya karşılamaz, çünkü ısı bir aracı olmadan da transfer edilebilir.
Yani ısı, ısı kaynağının kendisi tarafından her yöne yayılacak, ardından elde edilebilecek her yöne akacaktır. Temel olarak, tüm nesneler ısı radyasyonu yayabilir ve emebilir, ancak miktar maddenin sıcaklığına ve rengine bağlıdır.
Bir nesne etrafındaki sıcaklıktan ne kadar sıcaksa, çevresine o kadar fazla ısı yayar. Bu nedenle, sıcak bir cismin yüzey alanı daha büyükse, yayılacak ısı daha sıcak olacaktır.
Günlük yaşamdaki radyasyon vakalarına bir örnek, bir şenlik ateşi yaktığınızda sıcak hissetmesidir. Ateş kaynağının belirli bir mesafede olması nedeniyle, yakına getirildiğinde avuç içleri ısındığında radyasyon hissedilir. ateşle. Radyasyon için ısı formülü aşağıdaki gibidir.
Isı Hızı = Q/t = eσAT4
4. Isı Yalıtımı

Isı kolayca aktarılma özelliğine sahiptir. İletim, konveksiyon ve radyasyon yoluyla hareketin olmasını önleyebilirsiniz. Örneğin odayı izole ederek; Termos, su sıcaklığını sıcak veya ılık tutabilir, böylece ısı transferi önlenebilir.
Okumak: Gaz Maddesi
Kalori Problemi Örneği

Isı formülü, aşağıdaki soru örnekleri üzerinde çalışmak için kullanabileceğiniz bir yöntemdir!
1. Örnek Soru 1
Bir nesnenin sıcaklığı 5°C'dir ve 1500 J ısı emer. Cismin sıcaklığı 32°C olarak değişir. Nesnenin ısı kapasitesini hesaplayın!
Çözüm:
S = 1500 J
T = 32°C – 5°C = 27°C = 300°K
C = Q / T
C=1500/300
C = 5 J/°K
2. Örnek Soru 2
Suyun özgül ısısının 1000 J/kg°C olduğu biliniyorsa, 5 kg suyu 25°C ila 105°C arasında ısıtmak için gereken ısıyı hesaplayın!
Çözüm:
m = 5 kg
c = 1000 J/kg°C
T = 105°C – 25°C = 80°C
S = m. c. T
S = 5. 1000. 80
S = 400.000 J
3. Örnek Soru 3
Kütlesi 3 kg olan bir su 30°C'den 100°C'ye ısıtılıyorsa ve özgül ısısı 1 J/g°C ise, su için gereken ısı miktarını hesaplayınız!
Çözüm:
m = 3 kg
c = 1 g/°C = 1000 J/kg°C
T = 100°C – 30°C = 70°C
S = m. c. T
S = 3. 1000. 70
Q = 210.000 J
4. Örnek Soru 4
Bir sıvının kütlesi 5 kg'dır. Sıvı 200.000 J ısı gerektirir ve 20°C'den 80°C'ye ısıtılır. Sıvının özgül ısısını hesaplayın!
Çözüm:
m = 5 kg
S = 200.000 J
T = 80°C – 20°C = 60°C
c = Q/m. T
c = 200.000 / 5. 60
c = 200.000 / 300
c = 666,67 J/kg°C
5. Örnek Soru 5
Bir alüminyumun kütlesi 5 kg'dır. İlk sıcaklık 25°C'dir. Alüminyum 250.000 J ısı alıyorsa ve özgül ısısı 900 J/kg°C ise, alüminyumun son sıcaklığını hesaplayın!
Çözüm:
m = 5 kg
S = 250.000 J
c = 900 J/kg°C
T1 = 25°C
S = m. c. T
250.000 = 5. 900. (T2 – 25)
T2 – 25 = 250.000 / 5. 900
T2 – 25 = 250.000 / 4.500
T2 – 25 = 55,56
T2 = 55.56 + 25 = 80.56°C
6. Örnek Soru 6
25°C sıcaklıkta 300 gram su vardır, 1.500 kalorilik enerji ile ısıtılır. Suyun özgül ısısı 1 cal/g°C ise suyun ısıtıldıktan sonraki sıcaklığını hesaplayınız!
Çözüm:
m = 300 gram
T1 = 25°C
c = 1 kal/g°C
S = 1.500 kal
S = m. c. T
1.500 = 300. 1. (T2 – 25)
T2 – 25 = 1500 / 300. 1
T2 – 25 = 5
T2 = 5 + 25 = 30°C
7. Örnek Soru 7
40°C'den 65°C'ye ısıtılacak 300 gram su vardır. Suyun özgül ısısı 1 cal/g°C veya 4.200 J/kg°K ise, hesaplayın:
- Kalorilerde çok fazla ısı alınır
- Joule cinsinden ne kadar ısı alınır?
Çözüm:
m = 300 gr = 0,3 kg
T = 65 – 40 = 25°C
c = 1 cal/g°C = 4.200 J/kg°K
- Kalori olarak kalori
S = m. c. T
S = 300. 1. 25
Q = 7.500 kalori
- Joule cinsinden ısı
S = m. c. T
S = 0.3. 4.200. 25
Q = 31.500 kalori = 132.300 Joule
Yukarıdaki açıklamaya dayanarak, ısı formülü sadece salıverme ve talep etme etrafında dönmez. ısı, ancak ısı, ısı transferi, hatta her maddenin özgül ısısında bir değişiklik var. çeşitli. Mutlu pratikler ve umarım bu makale faydalı olur!
X KAPAT
Reklamlar
REKLAMCILIK
X KAPAT
