Kuantum Sayı Malzemesi: Türler, Örnek Problemler (Özet)
Yükleniyor...
Basitçe açıklandığında, kuantum sayısı elektronların konumunu ve enerji seviyelerini veya Atom çekirdeğinden bir kerede uzaklık, orbitallerin şekli, orbitallerin yönü ve Mekanik Atom Modelinde bulunan elektronların dönüşü Kuantum.
Her atomun bir yörüngesi vardır ve atomik yörüngelerin farklı enerji seviyeleri vardır. Atomlar farklıysa, aynı yörüngenin enerji düzeyi farklı bir enerji düzeyine sahip olacaktır, bu nedenle Hidrojen için 1s yörüngesi, Helyum için 1s yörüngesinden enerji düzeyinde farklılık gösterir.
İçindekiler listesi
Kuantum Sayılarının Tanımı

Dalga fonksiyonunda, bu sayının kuantum durumunun durumunu tanımlamak için özel bir anlamı vardır. Bu sayılar atomdaki elektronların durumunu tanımlayabilir. 1926'da Erwin Schrödinger Kuantum Mekaniği Teorisini önerdi.
Bu teori atomun yapısını açıklar. Bu kuantum mekanik atom modeli matematiksel bir denklemde, yani dalga denkleminde ifade edilir. Hidrojen atomu için denklemi çözmek, bir dalga fonksiyonu veya atomik yörünge verir.
Bu atomik yörünge, atomdaki kuantum elektron sayısının durumunu tanımlayacaktır. Dalga fonksiyonunun karesi, atom çekirdeği etrafındaki belirli bir hacimde elektron alma olasılığının yüksek olduğu anlamına gelir.
Heisenberg Belirsizlik İlkesi'nde olduğu gibi, elektronların atomlardaki konumu belirlenemez. Bilinebilecek tek şey, elektronun bulunma olasılığının en yüksek olduğu konumdur.
Kuantum Sayılarının Türleri
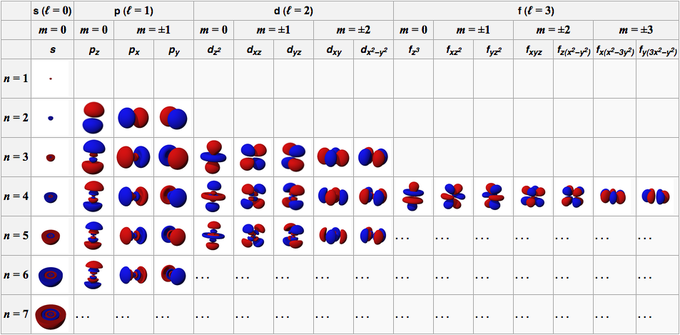
Bir atomun yörüngesi, yörüngeyi oluşturan dalga fonksiyonlarından oluşur. Genel koşullar altında, bir atomun yörünge özellikleri n, l, m ve s olmak üzere dört sayı ile tanımlanır.
1. Temel Kuantum Sayısı (n)
Bu sayı, 1'den (bir) başlayan pozitif tam sayılardan oluşur ve n'nin değeri 1, 2, 3, 4, 5 vb. yapılır. Bu sayı, bir atomdaki bir yörünge tarafından işgal edilen kabuğu ifade eder.
2. Azimut Kuantum Sayısı (l)
Bu sayı, 0'dan (sıfır) başlayan ve l 0, 1, 2, 3, 4, 5 vb. değerini yapan pozitif tam sayılardan oluşur. Bu sayıların kendi işaretleri vardır; 0, s yörüngesidir, 1, p yörüngesidir, 2, d yörüngesidir ve 3, f yörüngesidir.
3. Manyetik Kuantum Sayısı (m)
Bu sayı, 0'dan (sıfır) +/- 1'e kadar olan tam sayılardan oluşur, bu nedenle her yörünge için sayı değeri aynı değildir. s orbitali için m 0'dır çünkü s orbitalindedir, o zaman l 0'dır. Ancak, l'nin 2 olduğu d orbitalleri için m, -2, -1, 0, 1 ve 2'dir.
4. Spin Kuantum Sayı(lar)ı
Önceki sayı yörüngelerin yönünü gösteriyorsa, bu sayı 1/2 ve -1/2 değerlerine sahip elektronun dönüşünü tanımlar.
Okumak: Kuantum mekaniği
Yörüngeler ve Kuantum Sayıları
Her atomik yörüngenin benzersiz bir üç kuantum sayısı kümesi vardır. Bu sayılar temel kuantum sayısı (n), azimut veya açısal momentum (l) ve manyetiktir (m). Bu üç sayı birçok şeyi göstermektedir.
Bunlar, orbitallerin enerji düzeyini, boyut, şekil ve atomik orbitallerin olası radyal dağılımının yönelimini tanımlamayı içerir. Sonra, size bir yörüngedeki elektronun dönüşünü söyleyen bir sayı olan dönüş sayıları vardır.
Atomik Yörünge Şekli
Azimut sayı değerlerine göre dört çeşit atomik orbital vardır. Dört yörünge formu aşağıdaki gibidir.
1. s yörüngeleri
s yörüngesi, l = 0 olan bir yörüngedir. Merkezde atom çekirdeği ile küresel bir şekle sahiptir. Kürenin yalnızca bir yönü olduğundan, tüm S orbitallerinin yalnızca bir m değeri vardır, yani m = 0. 1s yörüngesi, atom çekirdeğindeki en yüksek elektron yoğunluğuna veya yoğunluğuna sahiptir.

Atom yoğunluğu, atom çekirdeğinden uzaklaştıkça yavaş yavaş azalır. 2s orbitalinin elektron yoğunluğu yüksek iki bölgesi vardır. İki bölgeden, o bölgede elektronlarla karşılaşma olasılığının sıfıra düştüğü küresel bir düğüm vardır.
Artan s yörünge köşelerinin modeli 4s, 5s vb. ile devam edecektir.
2. p. yörüngeler
p yörüngesi, l = 1 olan bir yörüngedir. Şekil, iki lob ile donatılmış bükülmüş bir balon gibidir. Loblar atom çekirdeğinin zıt taraflarındadır. Atom çekirdeği, yüksek elektron yoğunluğuna sahip iki lob arasında, p yörünge düğümü düzlemindedir.

p orbitalinin üç tür uzaysal yönelimi vardır, yani Px, Py ve Pz, bu nedenle üç olası m değeri vardır, yani -1, 0 veya +1. Üç yörünge, Kartezyen koordinatlarda x, y ve z eksenlerinde birbirine dik olarak yerleştirilmiştir. Şekil, boyut ve enerji aynıdır.
3. d yörüngesi
d yörüngesi, l = 2 olan bir yörüngedir. Bu yörüngenin beş farklı yönü vardır ve ona -2, -1, 0, +1 veya +2 olmak üzere beş olası m değeri verir. dxy, dxz, dyx ve d olan dört d orbitali2-y2.
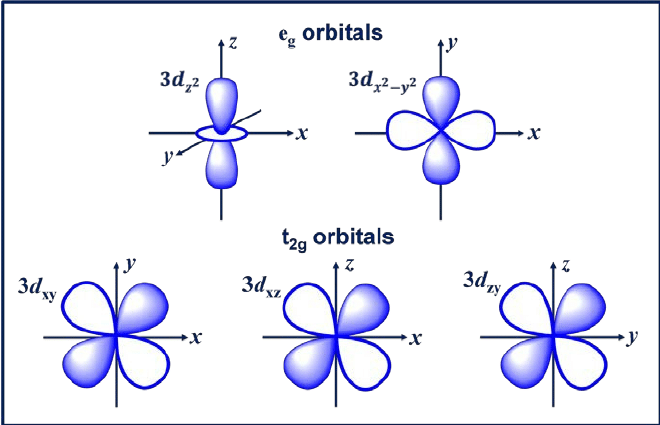
Bu yörüngelerin yonca yaprağı şeklinde dört lobu vardır. Sonraki d yörüngesi dzwz ekseninde iki ana lob ve ortada bir çörek şeklinde bölüm bulunan.
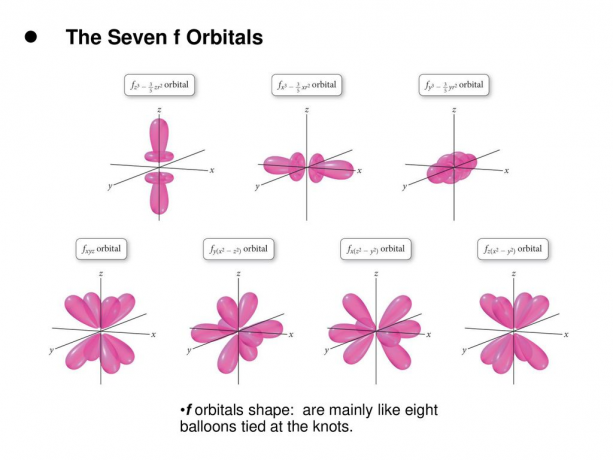
4. f. yörüngeler
f yörüngesi, l = 3 olan bir yörüngedir. Bu yörüngenin yedi tür yönelimi vardır, tıpkı yedi olası m değeri (2l + 1 = 7) olduğu gibi. Tüm f orbitalleri, değişen sayıda lob içeren karmaşık şekillere sahiptir.
Okumak: Elektron konfigürasyonu
Elektron konfigürasyonu
Kuantum Mekaniğinin Atom Teorisinde, atomlardaki elektronların varlığı ile orbitaller arasındaki ilişkinin nasıl olduğunu anladıktan sonra, Daha sonra elektron konfigürasyonunu, atom kabuklarındaki orbitallerdeki elektronların nasıl düzenleneceğini öğreneceksiniz. çok elektronlu.
1. Aufbau'nun Kuralı
Reklamcılık
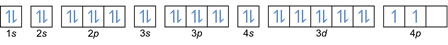
Bu kuralda elektronların düşük enerji seviyelerinden yüksek enerji seviyelerine doğru doldurulması gerektiği belirtilir. Yörüngelerin enerji seviyeleri, Kimyasal Elementlerin Periyodik Tablosundaki atomların dizilişinde görülebilir.
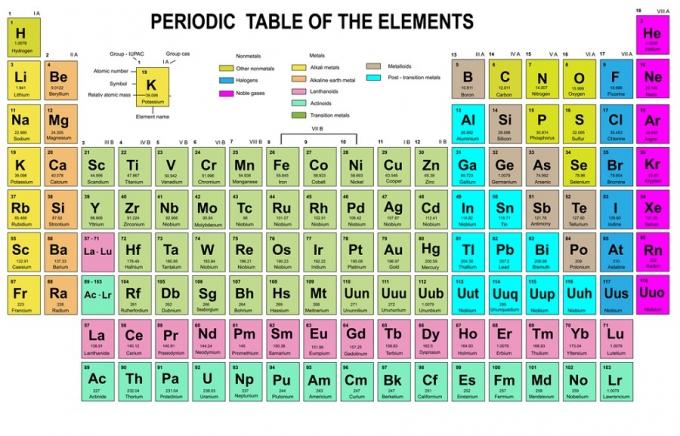
Tabloda s bloğunun olduğu yerde sol alt kırmızı, d bloğu için mavi, p bloğu için sarı ve f bloğu için yeşil renkle yazılmıştır. Her sıra bir cilt iken.
Bu düzenlemeye dayanarak, enerji seviyelerinin sırasının 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p vb. olduğunu görebilirsiniz.
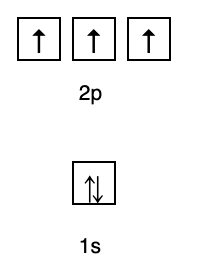
2. Hund Kuralları
Bu kural, eğer aynı enerji seviyesinde orbitaller varsa, o zaman elektronların olması gerektiğini belirtir. Aynı enerji seviyesindeki tüm orbitaller, Şekil 2'de gösterildiği gibi elektronlarla dolana kadar paralel olarak doldurulur. Takip etmek.
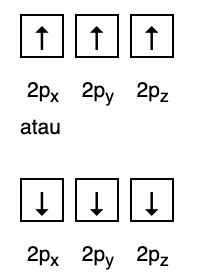
Bu arada, aşağıdaki şekil Hund Kuralı'ndaki dolguya uymuyor.
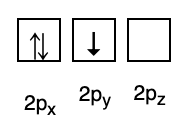
3. Pauli'nin yasağı
Pauli yasağı, elektronların bir yörüngeye doldurulduklarında aynı kuantum sayısına sahip olamayacaklarını belirtir, bu nedenle +1/2 değerinde bir dönüş sayısı/sayıları vardır. En düşük enerji, en yüksek sayıda eşleştirilmiş elektrona ve paralel dönüşe sahip olandır.
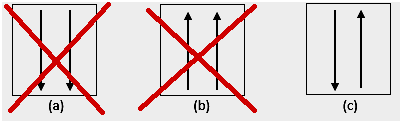
4. Anomali

Deneylere göre, yukarıda belirtilen kurallara göre elektron konfigürasyonunda anormallikler vardır. d alt kabuğu genellikle yarı dolu veya doludur. örneğin, için 24Cr, elektron konfigürasyonu: [Ar] 4s1 3d5, [Ar] 4s2 3d4'ten daha kararlıdır.
Ayrıca elektron konfigürasyonu 29Cu: [Ar] 4s1 3 boyutlu10, [Ar] 4s'den daha kararlı2 3 boyutlu9. Bu arada, K gibi tek atomlu iyonlar için elektron konfigürasyonu+, Na+, CA2+, Br–, S2-, vb. ilk önce nötr atom tarafından belirlenebilir.
Pozitif yüklü katyonlar veya iyonlar için monatomik Ax+ x+ yüküyle, nötr A atomunun dış elektron kabuğundan x kadar elektron çıkarılır. Anyona gelince, tek atomlu By- bir y yüküyle, henüz dolu olmayan en düşük enerjili yörüngede y kadar elektron yakalanır.
Kuantum Sayıları Nasıl Belirlenir
Sayıyı belirlemeden önce kuantum değerini bulmak istediğiniz elementin elektron konfigürasyonunu yapmalısınız. örneğin 16S. Elektron konfigürasyonu 1s2 2s2 2p6 3s2 3p4. Bundan sonra, 3p olan son elektron konfigürasyonunu alın.4.
- Bu konfigürasyona göre, ana sayı değeri 3'tür, çünkü 3 sayısı yörüngenin veya kabuğun boyutunu temsil eder.
- p elektronun bir alt kabuğudur, dolayısıyla l = 1 değeri altında elde edilebilir.
- p alt kabuğunda olduğu için kuantum sayısı -1, 0 veya +1 arasında olacaktır. Bunu belirlerken önce yörünge kutusunu çizin. Kutuyu doldururken okları kullanabilirsiniz.
- Her kutuyu yukarıyı gösteren bir okla doldurun, ardından aşağıyı gösteren bir okla doldurun. 4 sayısı, bu şekilde elde edilmesi için doldurulması gereken ok sayısıdır.
↑↓ ↑ ↑
-1 0 +1
- Dördüncü (son) ok, mekanik değerin m = -1 olduğu -1 kutusundadır.
- Yukarı ok +1/2, aşağı ok ise -1/2 değerindedir. Son ok aşağıyı gösteren oktur, dolayısıyla s = -1/2 değeri.
Kuantum sayısı bu şekilde belirlenir. İşte bu materyalle ilgili çalışmanız için bazı soru örnekleri.
Okumak: Fiziksel değişim
Kuantum Sayılarına Örnekler

Aşağıdaki sorulara göz atın!
1. Örnek Soru 1
Aşağıdaki elementlerin ve tek atomlu iyonların elektron konfigürasyonlarını ve elektron diyagramlarını belirleyin!
- 8Ö2-
- 20Mg2+
- 26Fe3+
- 27ortak
- 32Ge
Çözüm:
- Elektron konfigürasyonu 8O2:1s2 2s2 2p4 veya [O] 2s2 2p4
Elektron konfigürasyonu 8O2–: 1s2 2s2 2p6 veya [O] 2s2 2p6 veya [Ne] (artı 2 elektron: 2s2 2p4+2)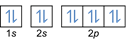
- Elektron konfigürasyonu 20mg: 1 sn2 2s2 2p6 3s2 3p6 4s2 veya [Ar] 4s2
Elektron konfigürasyonu 20Mg2+: 1s2 2s2 2p6 3s2 3p6 veya [Ar] (dış kabuktan 2 elektron çıkar: 4s2-2)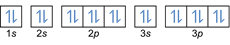
- Elektron konfigürasyonu 26Fe: 1s2 2s2 2p6 3s2 3p6 4s2 3 boyutlu6 veya [Ar] 4s2 3 boyutlu6
Elektron konfigürasyonu 26Fe3+: 1s2 2s2 2p6 3s2 3p6 3 boyutlu5 veya [Ar]3d5 (dış kabuktan 3 elektron çıkar: 4s2-2 3 boyutlu6-1)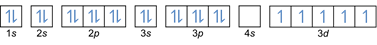
- Elektron konfigürasyonu 27Eş: 1s2 2s2 2p6 3s2 3p6 4s2 3 boyutlu7 veya [Ar] 4s2 3 boyutlu7
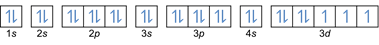
- Elektron konfigürasyonu 32Ge: 1s2 2s2 2p6 3s2 3p6 4s2 3 boyutlu10 4p2 veya [Ar] 4s2 3 boyutlu10 4p2
2. Örnek Soru 2
Ga'daki son elektronun bir kuantum numarası vardır...
- n = 4; l = 0
- n = 4; l = 1
- n = 3; l = 2
- n = 4; l = 2
- n = 3; l = 1
Çözüm:
Elementlerin Kimyasal Periyodik Tablosuna bakarsanız, Ga elementi IV. Periyottadır ve ona n = 4 verir. Galyum Grup 13'tedir, dolayısıyla değerlik elektronları p alt kabuğundadır, yani l = 1'dir.
3. Örnek Soru 3
Aşağıda, Cl atomunun son elektronu tarafından işgal edilemeyen kuantum sayısı...
- n = 3; l = 1; m = -1; s = -1/2
- n = 3; l = 1; m = 0; s =
- n = 3; l = 2; m = -1; s =
- n = 3; l = 2; m = 1; s = -1/2
- n = 3; l = 1; m = 1; s = 1/2
Çözüm:
Cl elementi 3. Periyotta olduğundan, n = 3. Cl aynı zamanda bir Grup 17'dir, dolayısıyla değerlik elektronları p alt kabuğundadır, yani l = 1. m'nin değeri -1, 0 veya +1 olabilir çünkü üç kuantum sayısının enerjileri aynıdır ve doldurma sırası önemli değildir.
Çünkü s aynı zamanda -1/2 veya 1/2 değerinde olabilir, bu nedenle m ve s'yi kesin olarak belirleyemeyiz.
4. Örnek Soru 4
X elementi3+ Ar elementi ile aynı elektron konfigürasyonuna sahiptir. Yani, iyonla aynı konfigürasyona sahip olan iyon...
- K+
- Mg2+
- Na+
- Cl+
- F–
Çözüm:
Ar elementi Periyot 3'tedir, bu nedenle iyon Ar veya [Ne] 3s ile aynı elektron konfigürasyonuna sahiptir.2 3p6 katyonlar için 4. Periyotta ve anyonlar için 3. Periyotta olacaktır. En uygun iyon K'dir.+.
5. Örnek Soru 5
Elemanın kuantum sayısını belirleyin 32Ge!
Çözüm:
Elektron konfigürasyonu 32Ge: 1s2 2s2 2p6 3s2 3p6 4s2 3 boyutlu10 4p2 veya [Ar] 4s2 3 boyutlu10 4p2.
Son yapılandırma 4p2. Enerji seviyesi 4'tür ve p alt kabuğundadır, yani n = 4 ve l = 1. 4p yörünge diyagramı çizimi2 aşağıdaki gibi diğer sayıları bilmek.
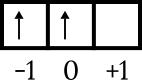
Son elektron kutu 0 yörüngesindedir, ok yukarıyı gösterir, yani m = 0 ve s = +1/2.
6. Örnek Soru 6
Aşağıdakilerin tümüne izin verilen kuantum sayılarına şunlar dışında...
- n = 2; l = 1; m = -1
- n = 3; l = 2; m = 1
- n = 3; l = 3; m = -1
- n = 3; l = 0; m = 0
- n = 3; l = 2; m = -1
Çözüm:
Ana sayının (n) değeri 3 ise, maksimum azimut sayısı (l) n-1 = 3-1 = 2'dir. Bu nedenle, n = 3, l = 3 ve m = -1 olan C seçeneklerine izin verilmez.
Kuantum sayılarını öğrenmek için, sıklıkla kullanılan veya problemlerde görülen elementlerin bazı atom numaralarına da hakim olmanız gerekir. Ek olarak, elektron konfigürasyonları oluştururken enerji seviyelerinin düzenlenmesine aşina olmalısınız.
X KAPAT
Reklamlar
REKLAMCILIK
X KAPAT
