Molarite ve Molalite Formülleri ve Örnek Problemler
Yükleniyor...
Çözeltinin kolligatif doğası, XI SMA sınıfındaki kimyasallardan biridir. Bu materyali anlamak için, bir çözeltinin molarite ve molalite formüllerine iyi hakim olmalısınız çünkü bu bölümün bir çözeltinin konsantrasyonu ile yakın bir ilişkisi vardır.
Bilmeyenler için, bir çözelti homojen bir çözücü karışımıdır (genellikle su veya H2O) çözünmüş madde ile. Bu materyali anlamanızı kolaylaştırmak için, burada bir çözümün molaritesi ve molalitesi hakkındaki soruların anlaşılmasından örneklere kadar sunuyoruz.
İçindekiler listesi
Molariteyi Anlamak

Molarite, çözelti hacmi başına bir çözünenin mol sayısını ifade eden bir çözünürlük ölçüsüdür. Molarite sembolü, molar birimlerin mol/litreye eşdeğer olduğu M (büyük) notasyonudur.
Okumak: Asit baz
molarite formülü

Daha önce molarite anlayışı olsaydı, o zaman formül ne olacak? İşte molarite formülü:
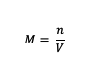
M = maddenin molaritesi (Molar veya mol/L)
n = bir maddenin molleri (mol)
V = çözelti hacmi (ml)
Yukarıdaki formüle ek olarak, molariteyi aşağıdaki formülü kullanarak da hesaplayabilirsiniz:
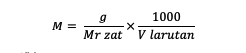
M = maddenin molaritesi (Molar veya mol/L)
g = madde kütlesi (gram)
Mr = maddenin bağıl moleküler kütlesi (gram/mol)
V = çözelti hacmi (ml)
Çözelti karıştırılırsa, formül geçerlidir:
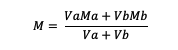
Va = a maddesinin hacmi
Vb = b maddesinin hacmi
Ma = maddenin molaritesi a
Mb = b maddesinin molaritesi
Çözelti seyreltilirse, uygulanan molarite formülü aşağıdaki gibidir:
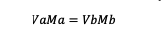
Va = a maddesinin hacmi
Vb = b maddesinin hacmi
Ma = maddenin molaritesi a
Mb = b maddesinin molaritesi
Mol değerini elde etmek için aşağıdaki formülü kullanarak hesaplamanız gerekir:
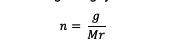
n = bir maddenin molleri (mol)
g = bir maddenin kütlesi (gram)
Mr = bir maddenin bağıl molekülü (gram/mol)
Molalitenin Tanımı

İlk bakışta benzer, ancak molarite farklı bilirsin molalite ile!
Molalite veya molal konsantrasyon, bir kilogram çözücü başına çözünen maddenin mol sayısıdır. Tanım olarak molalite, çözücünün birim ağırlığı başına çözünen maddenin mol sayısını belirten bir miktardır. Molalite, m (küçük) notasyonu ile gösterilir.
Okumak: Ohm Yasası
molalite formülü

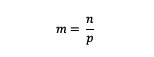
m = bir maddenin molalitesi (molalite)
n = bir maddenin molleri (mol)
p = çözücü kütlesi (gram)
Ayrıca molaliteyi aşağıdaki formülü kullanarak da hesaplayabilirsiniz:
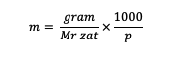
m = bir maddenin molalitesi (molalite)
Mr = bir maddenin bağıl molekülü (gram/mol)
p = çözücü kütlesi (gram)
Molarite ve Molalite Formülleri Arasındaki Fark
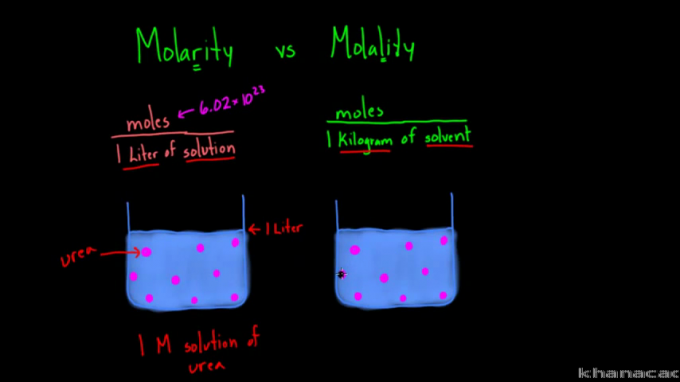
'Molarite' ve 'molarite' terimleri, benzer yazı ve telaffuzları nedeniyle çoğu zaman bazı insanların kafasını karıştırır. Her ikisi de bir çözeltinin konsantrasyonunu ölçmek için kullanılsa da, ikisi arasında farklar vardır.
Yukarıdaki formüle dayanarak, molarite ve molalite arasındaki farkın yaklaşımda yattığı görülebilir. Molarite veya molar konsantrasyon, bir litre çözelti başına bir maddenin mol sayısını ölçer. Molalite, kilogram çözücü başına bir maddenin mol sayısını ölçer.
Reklamcılık
Okumak: iş formülü
Molarite Problemleri ve Tartışma Örnekleri

Molarite ve molalite formülünü öğrendikten sonra, malzemeyi daha iyi anlamak için hemen problem üzerinde çalışmaya çalışmanız daha iyi olur. Hadi, sadece aşağıdaki soruları yap!
molarite sorunu
1. Çözünen maddenin kütlesinin 11 gram olduğu biliniyorsa, çözeltinin hacmi 500 mL ve Mr = 22'dir. molarite nedir?
Cevap :
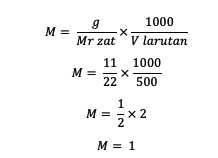
Yani maddenin molaritesi 1 mol/L'dir.
2. 20 ml hacimli 5 M HCl, 0.4 M'ye seyreltildi. Peki, çözeltiye ne kadar su eklenmelidir?
Cevap :
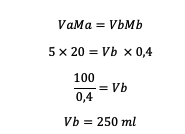
Yani eklenmesi gereken su miktarı 250 ml'dir.
3. Glikoz (C6H12Ö6) göreli kütlesi 180 olan, 500 mL 0.1 M glikoz çözeltisinde mevcuttur. glikozun kütlesi nedir?
Cevap :

Böylece, glikozun sahip olduğu kütle (C6H12Ö6) 9 gramdır.
4. H. çözeltisindeki çözücünün hacmi nedir?2BÖYLE4 0,2 M çözüneni 0,3 mol olan?
Cevap :
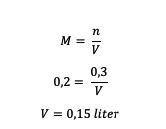
Yani çözücünün hacmi 0.15 litredir.
5. Toplam 18 gram glikoz (C6H12Ö6) ile Mr = 180, hacim 0,5 L olacak şekilde suda çözülür. Çözeltinin molaritesi nedir?
Cevap :

Her şeyden önce, önce mol sayısını hesaplayın
Ardından molarite değerini hesaplayın.
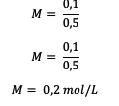
Bu nedenle, glikoz çözeltisinin molaritesi litre başına 0.2 mol'dür.
6. 100 mL 01, M NaOH çözeltisi yapmak için kaç gram NaOH (Mr = 40) çözülmelidir?
Cevap :

Bu nedenle, gerekli NaOH kütlesinin 0,4 gramını alır.
molalite sorunu
1. Bir çözeltinin kütlesi 11 gram çözünen, 200 gram çözücü ve Mr = 22 olduğu bilinmektedir. Peki, molalite nedir?
Cevap :
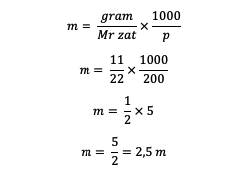
Böylece 2,5 m molalite değeri elde edilir.
2. Mr = 342 olan 17.1 gram şeker kamışı çözeltisine toplam 250 gram su eklenir. Çözeltinin molalitesi nedir?
Cevap :

Bu nedenle, çözeltinin molalitesi 0,2 m'dir.
3. 250 gram suda çözülmüş 4 gram NaOH çözeltisinin (Ar Na = 23, O = 16, H = 1 olduğu biliniyorsa) molalitesi nedir?
Cevap :
Molaliteyi hesaplamadan önce, önce bağıl kütleyi hesaplamamız gerekir.
Bay = 23 + 16 + 1 = 40 gram/mol
Daha sonra molaliteyi hesaplayalım.
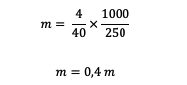
Bu nedenle, NaOH çözeltisinde bulunan molalite 0,4 m'dir.
4. Ar H = 1 ve Ar Cl = 35.5 olduğu biliniyorsa, % 37'lik bir HCl çözeltisinin molalitesi nedir?
Cevap :
Bay = 1 + 35.5 = 36,5 gram/mol
HCl kütlesi = %37 x 100 gram = 37 gram
Çözücü kütlesi = çözelti kütlesi – HCl kütlesi
Çözücü kütlesi = 100 – 37 gram
Çözücü kütlesi = 63 gram veya 0.063 kilogram
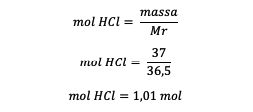
HCl'nin mollerini öğrendikten sonra molalitesini hesaplayın.
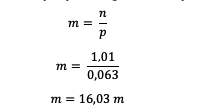
Böylece HCl'nin molalitesinin 16.03 molal olduğu görülebilir.
5. 15 gram üre CO(NH .?2)2 250 gram suda çözülür mü? (Bay = 60)
Cevap :
İlk önce üre molünü hesaplayın
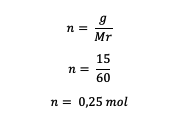
Ardından, çözümün molalitesini hesaplayın
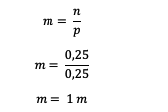
Böylece, üre çözeltisinin molalitesi 1 m'dir.
Sorunun tanımı ve örneklerinin eşlik ettiği molarite ve molalite formülü budur. Kolay değil mi? Umarım bu makale sayesinde anlayışınızı geliştirebilirsiniz, evet. Ruh!
X KAPAT
Reklamlar
REKLAMCILIK
X KAPAT
