Değerlik Elektronları: Tanımı, Nasıl Hesaplanır, Örnek Problemler
Yükleniyor...
Değerlik elektronları, diğer atomlarla etkileşimlere katılabilen bir atomun en dış seviyesindeki elektronlardır. Değerlik değeri, etkileşim değerinin görülebilmesi için bir atomu temsil edebilir.
Bir atomdaki değerlik sayısı, bir elementin reaktif veya inaktif olmasına neden olabilir. Bu nedenle ilgili bir elemanın etkinliğini bilmek için değerlik sayısını bilmek çok önemlidir.
İçindekiler listesi
Değerlik Elektronlarını Anlamak
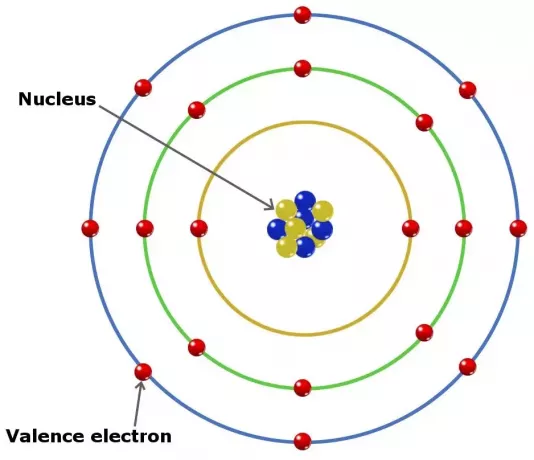
Atomlardaki değerlik elektronları, bir elementte kimyasal bağ oluşturmada rol oynayabilir. Ana gruptaki elementlerde değerlik elektronları en dış kabuktaki elektronlardır.
Öyle olsa bile, ancak bu tür elektronların tümü dış kabukta değildir. Geçiş grubuna ait bazı elementlerde değerlik dış kabuktan daha derindir.
Okumak: Elektron konfigürasyonu
Değerlik Elektron Tablosu
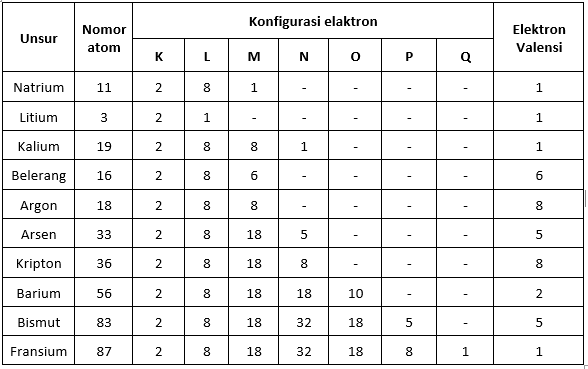
Değerlik Elektronları ve Elementlerin Periyodik Sistemi
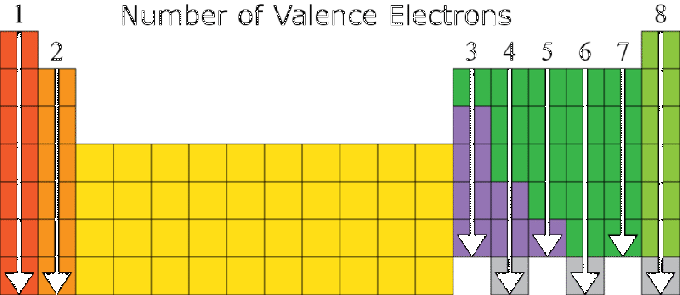
Bir elementin özellikleri, elektron konfigürasyonuna, özellikle de değerlik sayısına büyük ölçüde bağlıdır. Aynı sayıda değerliklere sahip elementler genellikle benzer özelliklere sahiptir. Bu nedenle periyodik elementler sistemi, artan atom numarasına ve bir maddenin özelliklerindeki benzerliklere göre düzenlenir.
Bir elementin atomunun elektron konfigürasyonu ile elementin periyodik sistemdeki konumu arasında bir ilişki vardır, burada:
- Grup numarası VIIIA grubundaki He elementi ve geçiş grubu dışında değerlik değerlerinin sayısı ile aynıdır.
- Periyot sayısı elektron üzerindeki kabuk sayısına eşittir.
Elektiriksel iletkenlik
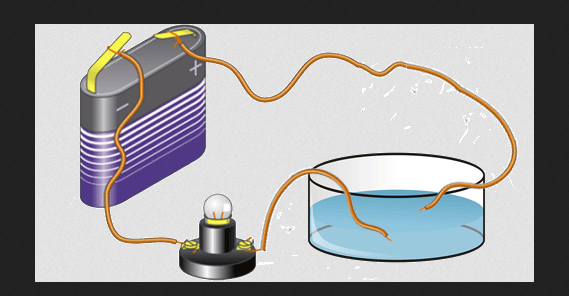
Değerlik elektronları ayrıca bir elementin elektriksel iletkenliğinden de sorumludur. Elementleri metal olmayanlar, yarı iletkenler ve metaller olarak gruplandıran şey budur. Metalik elementler, katı haldeyken genellikle yüksek elektrik iletkenliğine sahiptir.
Periyodik tablonun her satırında metal, ametalin solundadır. Bu nedenle metaller, metal olmayanlardan daha az değerliliğe sahiptir.
Ancak metal atomlarının değerlik değeri küçük bir iyonlaşma enerjisine sahiptir ve katı halde bu elektronlar 1 atomdan ayrılma veya diğer atomlarla birleşme konusunda nispeten serbesttir.
Bunun gibi serbest elektronlar bir elektrik alanının etkisiyle hareket ettirilebilir, hareketleri bir elektrik akımı içerebilir. Bu elektronlar metallerin elektriksel iletkenliğinden sorumludur. İyi iletken örnekleri alüminyum, bakır, altın ve gümüştür.
Metalik olmayan elementler düşük elektrik iletkenliğine sahiptir, bu nedenle yalıtkan görevi görürler. Bunun gibi elementler sağdaki periyodik tabloda görülebilir ve en az yarısı dolu bir değerlik kabuğuna sahiptir.
Elektronlar bir elektrik alanı ile karşılaştıklarında atomu kolayca terk edemiyorlarsa iyonlaşma enerjisinin büyük olduğu söylenir. Dolayısıyla bu tür bir element çok küçük akımları iletme yeteneğine sahiptir.
Yalıtım elemanlarının örnekleri arasında kükürt ve elmas bulunur. Metal atomlarının değerliliği bir iyonik bağ oluşturmak için kullanılıyorsa, metal içeren katı bileşiklerin de yalıtkan oldukları söylenebilir.
Okumak: Kuantum mekaniği
Elektron konfigürasyonu
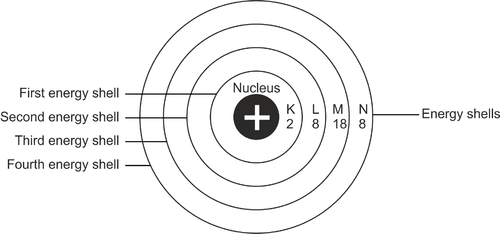
Konfigürasyon işleminin, bir atomdaki elektron dağılımının düzenlenmesi olduğu söylenebilir. Genel olarak, elektronlar bir atomda belirli bir yolda olacaktır. Bir atomun enerji düzeyine göre belirlenir. Bu yollar elektron kabuklarıdır.
Deri tabakasının ilk kısmı K harfi ile gösterilir. Cilt katmanları alfabetik sırayla L, M vb. şeklinde devam edecektir. K kabuğu atom çekirdeğine en yakın olanıdır. Kabuğun her katmanı yalnızca belirli sayıda elektronu barındırabilir.
Reklamcılık
Yani eğer doluysa elektronlar bir sonraki katmana geçecektir. Tüm cilt katmanlarının maksimum kapasitelerine kadar doldurulması gerekir.
Değerlik Elektronları Nasıl Sayılır

Elektronların atomu doldurmaya başladıkları zamanki konumu, kabuğun ilk katmanından başlamaktadır. Bu cilt tabakası atom çekirdeğine en yakın olanıdır veya K harfi ile gösterilir. İlk katman en düşük enerji seviyesine sahiptir. İlk katman 2 elektronla doldurulursa, L olarak adlandırılan sonraki katman doldurularak devam edilir.
L kabuğu 8 elektron kapasitesine sahiptir. Dolu ise yavaş yavaş bir sonraki cilt tabakasına geçilir. Bir atomun en dış kabuğunun toplam kapasitesi 8 elektrondur.
Ana gruba ait olan elementler, elektron dizilimi, elektron sayısına veya atom numarasına göre aşağıdaki kurallara göre belirlenebilir.
- Elektronlar, deri tabakasının barındırabileceği maksimum sınıra kadar tamamen yüklenecektir.
- Kalan elektronlar varsa veya elektron kabuğu katmanını maksimum ölçüde dolduramıyorsa, aşağıdaki hükümlere dikkat edin.
- Kalan elektron sayısı > 32 ise, kabuğun bir sonraki kısmı 32 elektronla doldurulur.
- Kalan elektronlar <32 ise, sonraki kabuk katmanı 18 elektronu barındıracaktır;
- Kalan elektronlar < 18 ise, bir sonraki katman 8 elektronla doldurulacaktır.
- Kalan sayı 8 ise, kalan elektronlar kabuğun bir sonraki bölümünü doldurabilir.
Okumak: Fiziksel değişim
Değerlik Elektron Problemlerine Örnekler

Malzemeyi daha derinlemesine anlamak için lütfen bazı örneklere ve aşağıdaki tartışmaya bakın.
örnek 1
Aşağıdaki elementlerin değerlik değerlerini elektron konfigürasyonlarına göre belirleyiniz.
- 11Na
- 13Al
- 15P
- 18Ar
- 19K
Cevap:
- 11Na = 2 8 1
Na = 1'in değerlik sayısı
- 13Al = 2 8 3
Değerlik sayısı Al = 3
- 15P = 2 8 5
Toplam değerlik P = 5
- 18Ar = 2 8 8
Değerlik sayısı Ar = 8
- 19K = 2 8 8 1
Değerlik sayısı K = 1
Örnek 2
Bir elektron konfigürasyonu oluşturun ve soy gaz elektron konfigürasyonlarını kullanarak aşağıdaki elementlerin değerlik değerlerini belirleyin.
- 20CA
- 35br
- 36cr
- 50Sn
- 86Rn
Cevap:
- 20Ca = [Ar] 4s2
Ca = 2 değerlik değerlerinin toplamı
- 35Br = [Ar] 3d10 4s2 4p5
Br = 7 değerlik değerlerinin toplamı
- 36Kr = [Ar] 3d10 4s2 4p6
Değerlik değerleri toplamı Kr = 8
- 50Sn = [Kr] 4d10 5s2 5p2
Sn = 4 değerlik değerlerinin toplamı
- 86Rn = [Xe] 4f14 5d10 6s2 6p6
Değerlik değerlerinin toplamı Rn = 8
Örnek 3
Aşağıdaki elementlerin elektronlarını yazınız ve değerlik değerlerini de belirleyiniz.
- 10 ne
- 33 BİZ
- 47 Ag
- 52 Te
- 54 Xe
Cevap:
- 10 Ne: 1s2 2s2 2p6
Ne = 8 değerlik değerlerinin toplamı
- 33 As: 1s2 2s2 2p6 3s2 3p6 4s2 3 boyutlu10 4p3
As = 5 değerlik değerlerinin toplamı
- 47 Ag: 1s2 2s2 2p6 3s2 3p6 4s2 3 boyutlu10 4p6 5s1 4d10
Ag = 1 değerlik değerlerinin toplamı
- 52 Te: 1s2 2s2 2p6 3s2 3p6 4s2 3 boyutlu10 4p6 5s2 4d10 5p4
Te = 6 değerlik değerlerinin toplamı
- 54 Xe: 1s2 2s2 2p6 3s2 3p6 4s2 3 boyutlu10 4p6 5s2 4d10 5p6
Xe = 8 değerlik değerlerinin toplamı
Değerlik elektronları, elektron konfigürasyonu kullanılarak belirtilen yol veya yörüngeye göre belirlenebilir. Oldukça karmaşık görünse de, bu materyale hakim olmak, sorular üzerinde kolayca çalışabilmek için yapılması gereken bir şeydir.
X KAPAT
Reklamlar
REKLAMCILIK
X KAPAT
