BİLEŞİKLER: Tanım, Türler, Örnekler
Yükleniyor...
İnsanlar farkında olmadan günlük yaşamlarında sıklıkla çeşitli bileşiklerle temasa geçerler. Belki de herkes bileşiğin ne anlama geldiğini anlamadığını fark etmese de. Aslında, tuz, şeker, su ve benzeri gibi sıklıkla bulunan birçok bileşik örneği vardır.
Genel olarak bileşikler, bileşenlerine göre çeşitli tiplere ayrılır. Bileşiklerin ayrışma işlemi kimyasal bir reaksiyonla gerçekleştirilir. Ayrıca her tür bileşiğin biçimini, dokusunu, tadını ve kokusunu da ayırt eder.
İçindekiler listesi
Bileşik Formülleri Adlandırma
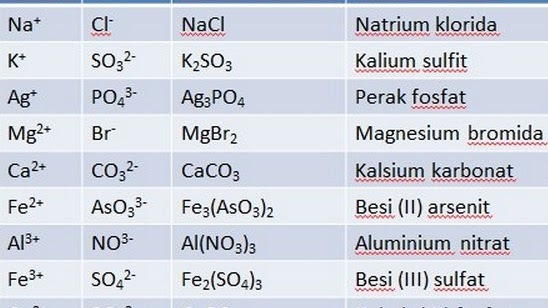
Bir bileşik, kimyasal bir reaksiyonla iki veya daha fazla maddeye ayrılabilen tek bir maddedir. Günlük yaşamda sıklıkla bulunan bir bileşiğe örnek sudur. Bu süreçte su, H20 kimyasal formülü ile oksijen (O) ve hidrojen (H) elementlerinin bir kombinasyonudur.
Endonezya Cumhuriyeti Eğitim ve Kültür Bakanlığı'nın resmi internet sitesinde yer alan habere göre, bir elementin en küçük parçasının bir atom olduğu belirtiliyor. İki atom kimyasal bir reaksiyonla birleşirse, bir molekül veya bir bileşiğin en küçük parçasını oluşturur.
Bu arada, kimyasal karıştırma ve termal veya elektriksel ayrışma yoluyla bileşikler oluşturma süreci. Bileşikler kendilerini oluşturan elementlerden farklı özelliklere sahiptir.
Örneğin suyun özellikleri, onu oluşturan elementlerin yani oksijen ve hidrojen gazının özelliklerinden farklıdır. Görünümdeki fark da çok gerçek. Su sıvı olduğu için hidrojen gazdır. Ayrıca yangınları söndürmek için su kullanılabilir.
Ancak hidrojen yanıcı bir maddedir. Oksijen ise yanma sürecinde ihtiyaç duyulan bir maddedir. Dolayısıyla, kurucu elementlerin ve ortaya çıkan bileşiklerin çok zıt özelliklere, formlara ve işlevlere sahip olduğu görülebilir.
Peki, bir bileşik ile bir karışım ve bir element arasındaki fark nedir? Bileşikler ve elementler tek maddeler olmasına rağmen. Bununla birlikte, bileşikler ve elementler ile karışımlar arasında farklılıklar vardır.
Bunun nedeni, elementin daha basit maddelere dönüştürülemeyen tek bir madde olması ve elementin orijinal özelliklerini veya özelliklerini korumaya devam etmesidir.
Öğe örnekleri:
- Altın
- Öncülük etmek
- Ütü
- Bakır
- Çinko
- Nikel
Karışım, iki veya daha fazla maddeden oluşan, ancak yine de orijinal maddenin özelliklerini taşıyan bir malzemedir. Karışım örnekleri şunları içerir:
- Hava
- nehir suyu
- Kaynak
- Çikolatalı süt
- iyot tuzu
- Kahve
- Tatlı çay
Okumak: Sıvı
Bileşik Türleri
Günlük yaşamdaki mutlak bileşik örnekleri hakkında daha fazla tartışmadan önce. Bileşik türlerini de ayırt edebiliyorsanız iyi olur.
Bileşen elementlere bağlı olarak, bileşikler birkaç türe ayrılır, yani aşağıdaki gibi:
1. Organik bileşik

Canlılardan ve fotosentez sürecinden gelir. Organik bileşikler, ana zincir olarak karbon (C) elementini içerir. Bu tür organik bileşik suda çözünmez olma ve yalnızca organik çözücülerle karıştırıldığında çözünür olma karakteristik özelliklerine sahiptir.
Karbon (C) elementinden oluştuğu için organik bileşiklerin daha yanıcı olma eğilimine girmesine neden olur. Organik bileşiğe bir örnek şekerdir (C12H22011)
2. inorganik Bileşik
Reklamcılık

Bu tür bir bileşik mineral kaynaklarından gelir. İnorganik bileşikler, organik bileşiklerden nispeten daha yüksek kaynama noktalarına sahiptir. Bununla birlikte, inorganik bileşikler yanmaz ve suda kolayca çözünür olma eğilimindedir. Örneğin, silikon dioksit (SiO2).
3. Ekşi

Hidrojen iyonları H bağışlayabilen moleküller+ ve Lewis asidi ile kovalent bir bağ oluşturur. Kimyada asit bileşikleri, Arrhenius, Bronsted-Lowry ve Lewis olmak üzere üç tanımdan oluşur.
Genel olarak, asitler aşağıdaki özelliklere sahiptir:
- Suda çözündüğünde ekşi.
- Metallerle karıştırıldığında şiddetli reaksiyona girer.
- Dokunulduğunda acı verir ve cilde zarar verme potansiyeline sahiptir.
- pH'ı 7'den az olsun.
- Asitler mutlaka iyonik olmasa da elektrolitlerdir.
- Mavi turnusol kağıdını kırmızıya çevirebilir.
Asitlerin, dekapaj veya dekapaj yoluyla metal nesnelerden pasın çıkarılması da dahil olmak üzere çeşitli kullanımları vardır. Ayrıca asit, ıslak pillerde elektrolit olarak da kullanılabilir. Sülfürik asit, benzin yapmak için katalizör olarak kullanılabilir.
Okumak: Asit baz
4. İyonik bileşikler

Bu terim, elektrostatik olarak bir arada tutulan iyonlardan (iyonik bağlar) oluşan kimyasal bir bileşiğe atıfta bulunur. Bu bileşik genel olarak nötr olmasına rağmen, her ikisi de sodyum, klorürden karbonata kadar pozitif yüklü iyonlardan (katyonlar) ve negatif yüklü iyonlardan (anyonlardan) oluşur.
İyonik bileşiklerin özellikleri:
- Düşük buhar basıncı ile çok yüksek kaynama noktasına sahiptir.
- Asidik bileşiklere alkalilik veya benzerlik.
- Çoğu iyonik bileşik türü çok kırılgandır.
- İyonik bileşiklerin sıkıştırılabilirliği yapı tarafından belirlenir.
- Su gibi polar sıvılarda kolayca çözünür. Bununla birlikte, benzinde çözülmesi zor olma eğilimindedir.
- Düşük iletkenlik ve genellikle önemli miktarda elektrik iletmez.
İyonik bileşiklerin çeşitli kullanım alanları vardır ve insanlar tarafından günlük yaşamda yaygın olarak kullanılır. İyonik bileşiklerin örnekleri arasında magnezya sütü, boraks ve sönmüş kireç bulunur.
5. Tuz

Kimyada tuz, negatif iyonlar (anyonlar) ve pozitif iyonlardan (katyonlar) oluşan iyonik bileşikler olarak sınıflandırılır, böylece yüksüz veya nötr bileşikler oluşturur. Tuz, klorür, asetat, florür, sülfat gibi bazların ve asitlerin sodyum klorüre reaksiyonundan oluşur.
Var olan tüm tuz türleri arasında her tuzun farklı bir tadı vardır, yani:
- Tatlı (kurşun ve asetat)
- Tuzlu (sodyum klorür)
- Asit (potasyum bitartrat)
- Tuzlu (monosodyum glutamat)
- Acı (magnezyum sülfat).
6. Oksit
Oksit bileşikleri oksijen atomları ve diğer elementleri içerir. Yer kabuğunun çoğunun oksitlerden oluştuğunu biliyor muydunuz? Bu bileşikler, elementler oksijen tarafından oksitlendiğinde oluşur. Oksitler, yüksek kaynama noktalarına sahip iyonik yapılara sahip olma eğilimindedir.
7. dil

Hidronyum iyonlarını emen bileşikler (H3O) suda çözündüğünde. Baz, pH'ı 7'den büyük olan bir asit veya kimyasal elementin ikilisidir. Bazlar genel olarak zayıf bazlar ve kuvvetli bazlar olmak üzere ikiye ayrılır. OH iyonlarını serbest bırakma yeteneğine bağlıdır.
Bazlar aşağıdaki gibi bazı ortak özelliklere sahiptir:
- Acı bir tadı vardır.
- Sabun gibi pürüzsüz taban dokusu.
- Kırmızı turnusolun rengini maviye çevirebilir.
- Elektrik akımını iletebilir.
- Asitleri nötralize edebilir.
- Hava koşullarına neden olur.
- pH değeri 7 sayısını aşıyor.
Okumak: Sağlam
Günlük Hayatta Bileşik Örnekleri

Günlük yaşamda canlılar bileşiklerden ayrılamazlar. Dahası, insanların hayatta kalmak için tükettiği pek çok bileşik vardır.
Aşağıdakiler, insanlar tarafından sıklıkla kullanılan bileşiklerin örnekleridir:
| Bileşik Örnek | Kimyasal formül |
| Karbon Monoksit Gazı | CO |
| Karbon Dioksit Gazı | CO2 |
| Azot Monoksit Gazı | NUMARA |
| su | H2Ö |
| mutfak tuzu | Sodyum Klorür / NaCl |
| Hidroklorik asit | HCI |
| Sülfürik asit | H2BÖYLE4 |
| Asetik Asit (Sirke) | CH3COOH |
| Amonyak Gazı | NH3 |
| Sodyum hidroksit | NaOH |
| Şeker | C12H22011 |
| Üre | CO(NH2)2 |
| Alkol | C2H3OH |
| Kalsiyum | CaCo3 |
Bileşik örnekleri ve çeşitlerini bilerek. Artık her gün kullanılan yiyeceklerde, içeceklerde ve nesnelerde ne tür bileşiklerin bulunduğunu daha iyi anlayabilirsiniz. Dolayısıyla ne tüketeceğiniz ve kullanacağınız konusunda da daha dikkatli olabilirsiniz.
X KAPAT
Reklamlar
REKLAMCILIK
X KAPAT
