วัสดุปฏิกิริยารีดอกซ์: แนวคิด การปรับสมดุล ตัวอย่าง
กำลังโหลด...
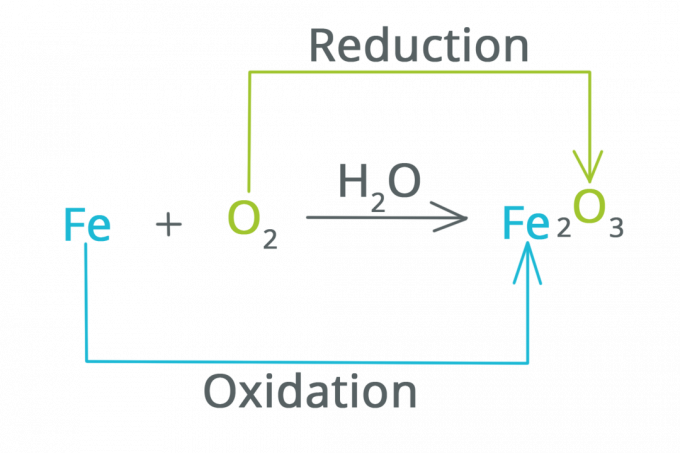
ตัวอย่างปฏิกิริยารีดอกซ์ที่เรามักได้ยินเมื่อเรียนมัธยม ปฏิกิริยารีดอกซ์เป็นปฏิกิริยาเคมีที่เกิดขึ้นจากปฏิกิริยารีดักชันและปฏิกิริยาออกซิเดชันร่วมกัน นั่นเป็นสาเหตุที่คำนี้กลายเป็นรีดอกซ์ (รีดักชั่น-ออกซิเดชัน)
ปฏิกิริยานี้รวมถึงกระบวนการทางเคมีทั้งหมดตั้งแต่อะตอมไปจนถึงการเปลี่ยนแปลงสถานะของเลขออกซิเดชันหรือสถานะออกซิเดชัน ในปฏิกิริยาเคมีที่สมบูรณ์ ปฏิกิริยาออกซิเดชันนี้จะตามด้วยปฏิกิริยารีดักชันเสมอ ดังนั้นจึงเรียกว่าปฏิกิริยารีดอกซ์
รายการเนื้อหา
การลดและการเกิดออกซิเดชัน

ดังที่ได้กล่าวไว้ก่อนหน้านี้ ปฏิกิริยารีดอกซ์เป็นตัวย่อของปฏิกิริยารีดักชันและปฏิกิริยาออกซิเดชันที่เกิดขึ้นเมื่อกระบวนการไฟฟ้าเคมีเกิดขึ้น
การรีดิวซ์เป็นปฏิกิริยาที่เลขออกซิเดชันลดลงและอิเล็กตรอนเพิ่มขึ้น กล่าวได้ว่าการลดลงเป็นปฏิกิริยาที่ทำให้สารสูญเสียออกซิเจน
ออกซิเดชันเป็นปฏิกิริยาที่เลขออกซิเดชันเพิ่มขึ้นและอิเล็กตรอนลดลง อาจกล่าวได้ว่าการเกิดออกซิเดชันเป็นปฏิกิริยาที่สารจับกับออกซิเจน
อ่าน: ของเหลว
หมายเลขออกซิเดชัน (Oilox)

แนวคิดของปฏิกิริยารีดอกซ์ที่เกี่ยวข้องกับการถ่ายโอนอิเล็กตรอนสามารถเกิดขึ้นได้ในสารประกอบไอออนิกเท่านั้น ในขณะที่สารประกอบโควาเลนต์ไม่สามารถทำได้ ดังนั้น แนวคิดรีดอกซ์ที่สามจึงเกิดขึ้น กล่าวคือขึ้นอยู่กับการเปลี่ยนแปลงของเลขออกซิเดชัน
เลขออกซิเดชันคือประจุบวกและลบของอะตอม องค์ประกอบที่มีสถานะออกซิเดชันเป็นบวกมักเป็นอะตอมที่มีธาตุโลหะ ในขณะที่องค์ประกอบที่มีสถานะออกซิเดชันเป็นลบ โดยทั่วไปจะใช้อะตอมที่ไม่ใช่โลหะ
ตามแนวคิดของการเปลี่ยนเลขออกซิเดชัน มีกฎแปดข้อในการกำหนดจำนวนนี้คือ:
- เลขออกซิเดชันของธาตุอิสระที่มีรูปร่างอะตอมและโมเลกุลเท่ากับ 0
- เลขออกซิเดชันของ monatomic และ polyatomic ion ตามประเภทของประจุบนไอออน
- เลขออกซิเดชันของธาตุในกลุ่ม IA, IIA, IIIA ตามหมู่ที่เป็นของ
- เลขออกซิเดชันขององค์ประกอบกลุ่มทรานสิชันมากกว่าหนึ่ง
- ผลรวมของเลขออกซิเดชันของธาตุที่ประกอบเป็นไอออน = ปริมาณประจุที่มี
- เลขออกซิเดชันของไฮโดรเจนเมื่อถูกพันธะกับโลหะ = -1 ในขณะที่ถ้า H ถูกพันธะกับอโลหะ จะเป็น +1
- จำนวนออกซิเจนในสารประกอบเปอร์ออกไซด์ = -1, จำนวนออกซิเดชันของ O ในสารประกอบที่ไม่ใช่เปอร์ออกไซด์ = -2
การลดและการออกซิไดซ์

ก่อนพูดถึงตัวอย่างปฏิกิริยารีดอกซ์ การรู้จักตัวรีดิวซ์และตัวออกซิไดซ์ก่อนนั้นไม่ใช่เรื่องเสียหาย ในปฏิกิริยาที่เกี่ยวข้องกับปฏิกิริยาออกซิเดชันและการลดลงพร้อมกับการเปลี่ยนแปลงของเลขออกซิเดชัน
สารออกซิไดซ์คือสารที่สามารถออกซิไดซ์สารหรือสารอื่น ๆ ที่ลดลงเมื่อทำปฏิกิริยา ในขณะที่ตัวรีดิวซ์เป็นสารที่สามารถลดสารอื่นๆ หรือสารที่เกิดปฏิกิริยาออกซิเดชันเมื่อทำปฏิกิริยา
อ่าน: แข็ง
ลักษณะปฏิกิริยารีดอกซ์
นอกเหนือจากตัวอย่างของปฏิกิริยารีดอกซ์ สิ่งอื่น ๆ ที่เราควรรู้คือลักษณะของปฏิกิริยานี้ ลักษณะดังต่อไปนี้ และอื่นๆ:
- มีตัวรีดิวซ์และตัวออกซิไดซ์
- มีการเปลี่ยนแปลงในสถานะออกซิเดชัน
- มีองค์ประกอบอิสระ เช่น คลอรีน ออกซิเจน คิวรัม และอื่นๆ
ฟังก์ชันปฏิกิริยารีดอกซ์

ปฏิกิริยารีดอกซ์มีหน้าที่หลายอย่างในชีวิตประจำวัน กล่าวคือ:
- เพื่อให้เข้าใจถึงกระบวนการกัดกร่อนของโลหะและวิธีป้องกัน
- การใช้ตะกอนเร่งในการบำบัดน้ำเสีย
- กระบวนการสังเคราะห์แสงของพืช
- มองเห็นการออกซิเดชั่นของอาหารในเซลล์
- สลักเกลียวและน็อตได้รับการเคลือบสังกะสี ในชั้นนี้มีกระบวนการออกซิเดชันของสังกะสีและการลดไอออนบวก
- ทำเครื่องครัวจากสแตนเลส ไม่เป็นสนิม
- การผลิตกรดซัลฟิวริกและแร่แปรรูปตามความต้องการทางอุตสาหกรรม
การปรับสมดุลปฏิกิริยารีดอกซ์

อันที่จริง ปฏิกิริยารีดอกซ์นี้เกิดขึ้นในตัวทำละลายที่เป็นน้ำ ดังนั้นสมการที่เขามีจะเกี่ยวข้องกับไอออน H+ และ OH- มี 2 วิธีที่ใช้ในการสอน คือ โดยวิธีเลขออกซิเดชันและปฏิกิริยาครึ่งหนึ่ง
การปรับสมดุลของปฏิกิริยารีดอกซ์สามารถทำได้โดยการปรับสมดุลหมายเลขออกซิเดชันหรือสถานะออกซิเดชัน ทั้งปฏิกิริยาโมเลกุลและไอออนิก วิธีการออกซิเดชันนี้ยึดตาม “ผลรวมของอีออกซิไดซ์ทั้งหมดเท่ากับปริมาณอีลดทั้งหมด”
ตัวอย่างปฏิกิริยารีดอกซ์ในชีวิตประจำวัน

ในตัวอย่างปัญหาปฏิกิริยารีดอกซ์ เรามักพบคำถามเกี่ยวกับปฏิกิริยารีดอกซ์ในชีวิตประจำวัน ต่อไปนี้เป็นตัวอย่างปฏิกิริยารีดอกซ์ในชีวิตประจำวัน ได้แก่
1. เสื้อผ้าฟอก
สารฟอกขาวเป็นสารประกอบที่สามารถขจัดสีออกจากวัตถุได้ ตัวอย่างเช่นสิ่งทอ การสูญเสียสีที่เกิดจากสารฟอกขาวเกิดจากปฏิกิริยาออกซิเดชัน
สารออกซิไดซ์ที่มักใช้ในสารฟอกขาว ได้แก่ ไฮโดรเจนเปอร์ออกไซด์และโซเดียมไฮโปคลอไรท์
2. กระบวนการสังเคราะห์แสงของพืช
การสังเคราะห์ด้วยแสงเป็นกระบวนการปฏิกิริยาออกซิเดชันลดทางชีวภาพตามธรรมชาติ การสังเคราะห์ด้วยแสงนั้นเป็นกระบวนการที่ซับซ้อนมาก
สิ่งมีชีวิตจากกระบวนการสังเคราะห์แสงสามารถใช้พลังงานในแสงแดดเพื่อผลิตน้ำตาลและออกซิเจนจากปฏิกิริยารีดอกซ์
3. การเผาไหม้โพรเพน
อีกตัวอย่างหนึ่งคือการเผาไหม้ ในการเผาไหม้ด้วยโพรเพน อากาศประกอบด้วย O2 ในขณะที่อะตอมของคาร์บอนจะถูกออกซิไดซ์และก่อให้เกิด CO2 ในขณะที่ออกซิเจนจะกลายเป็น H2O
อ่าน: สารแก๊ส
ตัวอย่างปัญหาปฏิกิริยารีดอกซ์

โฆษณา
1. กำหนดสถานะออกซิเดชันของธาตุในสารประกอบSO42- และ NaNO3
ตอบ:
ดังนั้น42– = polyatomic ion
Oxx ของ polyatomic ion = ประจุทั้งหมด = -2
Oxox ของ O ในสารประกอบ = -2
บล็อก S + 4 สถานะออกซิเดชัน = -2
-6 + 4. (-2) = -2
ดังนั้น เลขออกซิเดชันของ S = -6 และเลขออกซิเดชันของ O = -2
นาโน3 = ทบต้นโดยไม่คิดค่าใช้จ่าย
สถานะออกซิเดชันทั้งหมด = 0
Oxox ของ O ในสารประกอบ = -2
Oxx ของ Na (โลหะ) = จำนวนเวเลนซ์อิเล็กตรอน = +1
สถานะออกซิเดชันคือ Na + หมายเลขออกซิเดชันคือ N + 3 สถานะออกซิเดชัน = 0
+1 + (+5) + 3. (-2) = 0
ดังนั้น สถานะออกซิเดชันของ Na = +1 สถานะออกซิเดชันของ N = +5 และสถานะออกซิเดชันของ O = -2
2. ข้อใดต่อไปนี้เป็นตัวออกซิไดซ์ ตัวรีดิวซ์ ตัวรีดิวซ์ และผลิตภัณฑ์ของปฏิกิริยาเคมีต่อไปนี้
เฟ + HCl → FeCl3 + โฮ2
ตอบ:
ตัวออกซิไดซ์ (ลดลง) = HCl
ตัวรีดิวซ์ (ประสบกับการเกิดออกซิเดชัน) = Fe
ผลิตภัณฑ์ออกซิเดชัน = FeCl3
ผลการลด = H2
3. สมดุลสมการรีดอกซ์ต่อไปนี้
บี2อู๋3 + ClO– → 2BiO3– + Cl– (บรรยากาศทางภาษา).
ตอบ:
วิธีการออกซิเดชันหมายเลข
การชาร์จซ้ายและขวาที่เท่ากัน: 2OH– + บี2อู๋3 + ClO– → 2BiO3– + Cl–
จำนวนอะตอมเท่ากัน: 2OH– + บี2อู๋3 + 2ClO– → 2BiO3– + 2Cl– + โฮ2อู๋
ปฏิกิริยาที่เท่าเทียมกัน: 2OH– + บี2อู๋3 + 2ClO– → 2BiO3– + 2Cl– + โฮ2อู๋
ครึ่งปฏิกิริยาทาง
รีดอกซ์: Bi2อู๋3 + 2ClO– → 2BiO3– + 2Cl–
สมดุลค่าใช้จ่ายโดยการเพิ่มOH– (ฐาน).
2OH– + บี2อู๋3 + 2ClO– → 2BiO3– + 2Cl–
สมดุลจำนวนอะตอมโดยการเพิ่มH2โอ.
2OH– + บี2อู๋3 + 2ClO– → 2BiO3– + 2Cl– + โฮ2อู๋
ปฏิกิริยาที่เท่าเทียมกัน: 2OH– + บี2อู๋3 + 2ClO– → 2BiO3– + 2Cl– + โฮ2อู๋
การศึกษาตัวอย่างปฏิกิริยารีดอกซ์และแม้แต่การอภิปรายที่สมบูรณ์ไม่ใช่เรื่องง่าย นอกจากนี้ยังมีสารประกอบมากมายที่ต้องจดจำในเนื้อหานี้ ดังนั้นอย่ารีรอที่จะฝึกฝนต่อไปเพื่อทำความเข้าใจให้ดี
โฆษณา
X ปิด
