กฎของฟาราเดย์: เสียง สูตร ปัญหาตัวอย่าง
กำลังโหลด...
คุณรู้หรือไม่ว่ากฎของฟาราเดย์คืออะไร? หนึ่งในกฎหมายที่เกี่ยวข้องกับแม่เหล็กไฟฟ้าและให้การคาดการณ์ปฏิสัมพันธ์ระหว่างวงจรไฟฟ้าและสนามแม่เหล็กเพื่อให้สามารถผลิตแรงเคลื่อนไฟฟ้าได้
ค้นพบในปี พ.ศ. 2376 โดยนักวิทยาศาสตร์ชาวอังกฤษ Michael Faraday จนถึงปัจจุบันยังคงใช้อยู่และมีประโยชน์มากในบางสาขา คุณต้องการที่จะรู้ว่ามันหมายถึงอะไรและตัวอย่างของคำถาม?
รายการเนื้อหา
กฎข้อที่ 1 ของฟาราเดย์

กฎของฟาราเดย์มีอยู่ 2 ข้อ ข้อแรกเกี่ยวข้องกับกระบวนการอิเล็กโทรลิซิสและประจุไฟฟ้า
อ่านว่า "มวลของสารที่ผลิตจากอิเล็กโทรดระหว่างกระบวนการอิเล็กโทรลิซิสจะเป็นสัดส่วนโดยตรงกับปริมาณประจุไฟฟ้าที่ใช้"
สมการที่ใช้คือ:
W Q
W = มวลของสาร
Q = ประจุไฟฟ้าของอิเล็กตรอน
การใช้งานคือ:
Q = i x t
ผม = กระแสไฟฟ้า (เป็นแอมแปร์)
t = เวลา (เป็นวินาที)
โดยมีคำอธิบายว่าผลรวมของการใช้ประจุไฟฟ้าจะมีผลเท่ากับผลคูณของกระแสไฟตามเวลา
นอกจากนี้ยังมีความคล้ายคลึงกันมากขึ้นจากผลของการใช้กฎหมายข้างต้น กลายเป็น:
w I x ta
สำหรับสูตรที่ใช้ในการสมัครคือ
W = e.i.t/F
ข้อมูล:
W = มวลของสารที่ผลิตในกระบวนการอิเล็กโทรลิซิส (หน่วยเป็นกรัม)
e = มวลเทียบเท่า
ผม = ความแรงกระแส (เป็นแอมแปร์)
t = เวลา (เป็นวินาที)
F = ความมุ่งมั่นของฟาราเดย์ด้วยจำนวนที่แน่นอน 96,500 คูลอมบ์/โมล
การประยุกต์ใช้กฎของฟาราเดย์ในโลกแห่งเคมีสามารถเห็นได้จากส่วนประกอบหลายอย่างที่เกี่ยวข้องกับกระแสไฟฟ้าและอิเล็กโทรไลซิส
เช่นเดียวกับในเครื่องกำเนิดไฟฟ้าซึ่งเป็นอุปกรณ์พิเศษที่ทำหน้าที่สร้างพลังงานไฟฟ้าผ่านแหล่งทางกลและใช้การเหนี่ยวนำแม่เหล็กไฟฟ้า เครื่องกำเนิดไฟฟ้ามีสองประเภทคือกระแสไหลไปมาและโดยตรง
แอปพลิเคชั่นต่อไปคือไดนาโมซึ่งมีสองประเภทคือกระแสสลับและกระแสตรง
อ่าน: กฎของเคอร์ชอฟฟ์
กฎข้อที่ 2 ของฟาราเดย์

ตรงกันข้ามกับกฎข้อที่ 1 ของฟาราเดย์ มีอีกหนึ่งวินาทีที่มีเสียงว่า "มวลของสารที่ผลิตโดย อิเล็กโทรดระหว่างกระบวนการอิเล็กโทรลิซิสจะเป็นสัดส่วนโดยตรงกับมวลที่เท่ากันของสาร ที่.
แม้ว่ามวลของสารจะมีความหมายว่า มวลของสารที่อยู่ในการบังคับใช้กฎหมาย จากนั้นมวลที่เท่ากันคือมวลของสาร โดยปริมาณสารสัมพันธ์ที่มีจำนวนโมลเท่ากับ 1 โมลของอิเล็กตรอน
สมการคือ:
มวลสาร มวลเทียบเท่าสาร
w ME
ME = สถานะออกซิเดชันหรือประจุของไอออน/Ar
สูตรที่ใช้ในการประยุกต์กฎข้อที่สองนี้คือ:
W1/W2 = e1/e2
ข้อมูล:
W1 = มวลของสารที่หนึ่ง (เป็นกรัม)
W2 = มวลของสารที่สอง (เป็นกรัม)
e1 = มวลเท่ากันของสารตัวแรก
e2 = มวลเทียบเท่าของสารที่สอง
ในการใช้กฎข้อที่สองนี้ ฟังก์ชันมวลเทียบเท่ามีความสำคัญมาก หารด้วยการเปลี่ยนแปลงเลขออกซิเดชันที่เกิดขึ้นในปฏิกิริยาอิเล็กโทรไลซิส
สมการคือ:
เอ็มต้นโอ๊ก = อร
เปลี่ยนเลขออกซิเดชัน
เมื่อพูดถึงแนวคิดพื้นฐานเกี่ยวกับปริมาณสัมพันธ์ มีความสัมพันธ์ระหว่างมวล จำนวนโม และมวลของฟันกราม ซึ่งจะสัมพันธ์กันอย่างใกล้ชิดกับการใช้กฎข้อที่ 1 และ 2 ของฟาราเดย์ร่วมกัน
สมการคือ:
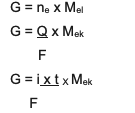
สรุปเป็นสมการรวมระหว่างและ 2 กล่าวคือ:
โฆษณา
G ~ i x t x Mต้นโอ๊ก
ข้อมูล:
G = มวลของผลิตภัณฑ์ (เป็นกรัม)
Q = ประจุไฟฟ้า (ในหน่วยคูลอมบ์)
ผม = ความแรงของกระแสไฟฟ้า (เป็นแอมแปร์)
t = เวลา (เป็นวินาที)
เอ็มต้นโอ๊ก= มวลเทียบเท่าของสาร (หน่วยกรัม/โมล)
F = ค่าคงที่ของฟาราเดย์ซึ่งเท่ากับ 96,500 คูลอมบ์/โมล)
อ่าน: กฎของฮุค
ตัวอย่างปัญหากฎหมายฟาราเดย์
เพื่อให้เข้าใจการประยุกต์ใช้กฎหมายของฟาราเดย์ดียิ่งขึ้น ต่อไปนี้คือตัวอย่างบางส่วนของการประยุกต์ใช้
1. ตัวอย่าง 1
มีการสะสม Cu ในวงจรไฟฟ้าที่มีขนาด 5 กรัม มวลของ Ag ตกตะกอนที่ขั้วไฟฟ้าเท่าใด สำหรับข้อมูลเพิ่มเติม Ag = 108 และ Cu = 63.5
สำหรับสูตรการหามวลของ Ag หรือ WAg คุณสามารถใช้สูตรต่อไปนี้:
WCu = MECu
WAg= MEAg
ME เป็นที่รู้จักโดยสมการ = อาr
หมายเลขออกซิเดชัน = 2
เป็นที่รู้จัก:
WCu = 5 กรัม
ขั้นแรกให้คำนวณ ME ของสารทั้งสองโดยใช้ปฏิกิริยารีดักชันของทั้ง Cu และ Ag ดังนี้
Cu2+ + 2e– → Cu(s), MEลูกบาศ์ก
= เอr = 63,5
เลขออกซิเดชัน =2
= 31,75
Ag+ + อี– → Ag(s) MEAg
= เอr = 108
เลขออกซิเดชัน = 1
= 108
5gCu ถัดไป = 31.75
WAg 108
= 17
ดังนั้นมวลของ Ag ที่ตกตะกอนคือ = 17 กรัม
2. ตัวอย่าง 2
ต้องใช้กี่ฟาราเดย์ในการลด Ca. ions?2+ ด้วยปริมาณ 12 กรัม? นี่คือการอภิปราย:
Ca2+→ ความจุคือ 2
Ar of Ca คือ 40
สูตรที่ใช้คือ W = e x F
จะหา F = W/e. ได้ที่ไหน
คำตอบคือ:
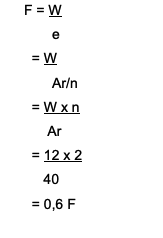
ดังนั้นจึงต้องใช้เวลา 0.6 ฟาราเดย์ในการลด Ca. ไอออน2+ ซึ่งมีจำนวนถึง 12 กรัม
อ่าน: กฎของคูลอมบ์
3. ตัวอย่างที่ 3
กระแสไฟฟ้า 0.2 แอมแปร์สามารถไหลได้เป็นระยะเวลา 50 นาที จากนั้นเข้าสู่เซลล์อิเล็กโทรลิซิสที่มีสารละลาย CuCl2. ปริมาณของตะกอน Cu ที่จะก่อตัวที่แคโทดคือเท่าใด เป็นข้อมูลเพิ่มเติม Ar จาก Cu = 63.5
เป็นที่รู้จัก:
กระแสไฟที่มีสัญลักษณ์ I = 0.2 แอมแปร์
เวลาที่มีสัญลักษณ์ t = 50 นาที หากใช้เป็นวินาทีคือ 50 x 60 วินาที ซึ่งเท่ากับ 3,000 วินาที
ถาม: WCu?
คำตอบ: ขั้นแรกให้เขียนปฏิกิริยารีดิวซ์ Cu คือ:
Cu2+ (aq) + 2e+ → ลูกบาศ์ก
ฉันCu = อา
เลขออกซิเดชัน = 63.5/2
= 31,75
สูตรที่ใช้หา Wลูกบาศ์ก เป็น:
Wลูกบาศ์ก = (1/96,500) x i x t x MEลูกบาศ์ก
= (1/96,500) x 0.2 A x 3,000 s x 31.75
= 0.197 กรัม
ดังนั้น ค่าของการสะสม Cu ที่เกิดขึ้นคือ 0.197 กรัม
4. ตัวอย่างที่ 4
ในอิเล็กโทรลิซิสที่มีอิเล็กโทรดชนิดคาร์บอน สามารถผลิตตะกอนชนิด Cu ได้ในปริมาณ 12.7 กรัม ใช้กระแสไฟ 4 แอมแปร์ อิเล็กโทรไลซิสจะใช้เวลานานแค่ไหน?
เป็นที่รู้จัก:
Ar ของ Cu = 63.5
ถาม: ว?
ตอบ:

ดังนั้นเวลาในการอิเล็กโทรไลซิสคือ 9,650 วินาที โดยใช้สูตรจากกฎของฟาราเดย์ที่ใช้
สำหรับผู้ที่กำลังศึกษาวิชาเคมี คุณจะต้องมีความเข้าใจที่ถูกต้องเกี่ยวกับกฎของฟาราเดย์ เพื่อว่าเมื่อได้รับมอบหมายงานที่เกี่ยวข้องกับการบังคับใช้กฎหมายแล้วสามารถตอบได้ถูกต้องและทั่วถึงโดยใช้สูตรที่มีอยู่แล้ว
X ปิด
โฆษณา
โฆษณา
X ปิด
