สารละลายบัฟเฟอร์: หลักการ, ประเภท, ตัวอย่างปัญหา
กำลังโหลด...
หนึ่งในวัสดุที่กล่าวถึงในวิชาเคมีคือสารละลายบัฟเฟอร์ซึ่งมีบทบาทสำคัญในการทำให้ pH คงที่ ทั้งในร่างกายและในปฏิกิริยาเคมีบางอย่าง โซลูชันนี้เรียกอีกอย่างว่าสารละลายบัฟเฟอร์หรือบัฟเฟอร์
สารละลายบัฟเฟอร์มักรวมอยู่ในผลิตภัณฑ์ที่ใช้ในชีวิตประจำวัน ตัวอย่างง่ายๆ คือ ยาหยอดตาที่ไม่ก่อให้เกิดอาการแสบร้อนเมื่อหยดเข้าตา มันเกิดขึ้นได้อย่างไร? ต่อไปนี้คือคำอธิบายโดยละเอียดของโซลูชันบัฟเฟอร์
รายการเนื้อหา
คำจำกัดความของบัฟเฟอร์โซลูชัน

สารละลายบัฟเฟอร์เป็นสารละลายที่ไม่เปลี่ยนระดับ pH เลยเมื่อเติม น้ำและมีการเปลี่ยนแปลงเล็กน้อยเมื่อผสมกับกรดหรือด่างที่มีความเข้มข้นสูง ต่ำ.
กล่าวอีกนัยหนึ่ง สารละลายนี้เรียกว่าบัฟเฟอร์มีระดับ pH ที่มีแนวโน้มว่าจะคงที่แม้ว่าจะเติมของเหลวอื่นๆ ลงไปก็ตาม ตัวอย่างเช่น บัฟเฟอร์ที่มีค่า pH 5 จะยังคงอยู่ในระดับเดิมหลังจากผสมกับน้ำ
บัฟเฟอร์ที่มีค่า pH 5 มักจะเปลี่ยนเป็นระดับ 5.1 หรือ 4.9 หลังจากเติมสารละลายกรดหรือเบสเล็กน้อย ดังนั้นจึงไม่มีการเปลี่ยนแปลงระดับ pH ให้สูงหรือต่ำเกินไป
คุณสมบัติของบัฟเฟอร์โซลูชั่น

วิธีง่ายๆ ในการระบุและแยกแยะบัฟเฟอร์จากโซลูชันประเภทอื่นๆ คือการทราบคุณสมบัติของบัฟเฟอร์ คุณลักษณะบางอย่างของบัฟเฟอร์ ได้แก่ :
- มีความสามารถในการรักษาค่า pH เริ่มต้นแม้จะเติมสารละลายอื่นๆ เช่น น้ำ เบสแก่ หรือกรดแก่ที่มีระดับที่แน่นอน
- สามารถรักษาค่า pH เริ่มต้นได้แม้ว่าสารละลายจะผ่านกระบวนการเจือจาง
- พลังในการรักษา pH จะเพิ่มขึ้นหากมีโมลจำนวนมาก
- สามารถคงค่า Ka ไว้ได้ทั้งที่อุณหภูมิที่เปลี่ยนแปลงบ่อยหรือที่อุณหภูมิคงที่
อ่าน: ของเหลว
หลักการแก้ปัญหาบัฟเฟอร์

โปรดทราบว่าบัฟเฟอร์แบ่งออกเป็น 2 ประเภท ได้แก่ สารละลายที่เป็นกรดและด่าง มันหมายความว่าอะไร?
- บัฟเฟอร์กรดเป็นสารละลายชนิดหนึ่งที่ทำจากส่วนผสมของกรดอ่อนและเบสคอนจูเกตเพื่อให้มีประสิทธิภาพในการรักษาค่า pH เริ่มต้นในสภาวะที่เป็นกรด
ตัวอย่างของบัฟเฟอร์กรดคือ CH3COOH และ CH3COO– หรือ CH3COOH และ CH3COONa, HF และ NaF รวมทั้ง NaH2ป4 และ NaHPO4. - บัฟเฟอร์เบสเป็นสารละลายชนิดหนึ่งที่มาจากเบสอ่อนและกรดคอนจูเกตซึ่งผสมกันเพื่อให้สามารถรักษาค่า pH เริ่มต้นในสภาวะที่เป็นด่างได้
ตัวอย่างของบัฟเฟอร์ฐานคือ N2ชม4 และ นู๋2ชม5+ เช่นเดียวกับ NH3 และ NH4+.
กรดและเบสที่ผสมกับคอนจูเกตตามลำดับจะทำให้เกิดสมดุลไอออนิกในน้ำ เป็นผลให้สารละลายบัฟเฟอร์สามารถรักษาค่า pH ให้อยู่ในช่วงที่กำหนดโดยไม่เปลี่ยนแปลงมากนัก
แล้วมันทำงานยังไง? นี่เป็นภาพประกอบง่ายๆ ที่จะชี้แจง:
- ถ้ามีส่วนผสมของเบสอ่อน (NH4OH) และกรดคอนจูเกตถูกเติมลงในเบสจำนวนเล็กน้อย ปฏิกิริยาจะเกิดขึ้นโดยไอออน OH– และไอออนบวกจากกรดคอนจูเกต (NH4+);
- ถ้ามีส่วนผสมของกรดอ่อน (CH3COOH) และฐานคอนจูเกต (CH3COO–) ถูกเติมลงในสารละลายกรดในปริมาณที่ค่อนข้างน้อย ปฏิกิริยาจะเกิดขึ้นระหว่าง H. ไอออน+ และไอออนลบจากฐานคอนจูเกต (CH3COO–).
อ่าน: ปริมาณสัมพันธ์
ฟังก์ชันสารละลายบัฟเฟอร์

ในชีวิตประจำวัน บัฟเฟอร์มีประโยชน์อย่างมากสำหรับมนุษย์และพืช ฟังก์ชั่นที่ตั้งใจไว้คืออะไร?
- สำหรับพืช บัฟเฟอร์จะใช้เพื่อปรับสมดุลระดับ pH ในพืชที่ปลูกโดยใช้ระบบไฮโดรโปนิกส์ ระดับ pH ที่สมดุลจะส่งผลดีต่อการพัฒนาพืช
- สำหรับมนุษย์ บัฟเฟอร์มีบทบาทในการรักษาค่า pH ของเลือดให้ไม่เปลี่ยนแปลง ระดับ pH ในเลือดจะถูกรักษาอย่างเหมาะสมเพื่อให้กระบวนการเผาผลาญในร่างกายทำงานได้อย่างราบรื่น ประเภทคือบัฟเฟอร์เฮโมโกลบิน บัฟเฟอร์ฟอสเฟต และบัฟเฟอร์คาร์บอเนต
- สำหรับมนุษย์ บัฟเฟอร์ยังมีหน้าที่อื่น คือ รักษาระดับ pH ให้คงที่ในปาก เพื่อไม่ให้ฟันผุ น้ำลายจะปล่อยสารละลายเพื่อรักษา pH เพื่อให้กรดจากอาหารที่เข้าสู่ปากเป็นกลาง
ความจุโซลูชันบัฟเฟอร์

ในความเป็นจริง สารละลายบัฟเฟอร์มีความจุซึ่งเรียกอีกอย่างว่าความเข้มข้นของบัฟเฟอร์หรือดัชนีบัฟเฟอร์ ความจุบัฟเฟอร์เป็นการวัดที่แสดงความสามารถของบัฟเฟอร์ในการรักษาระดับ pH ที่สม่ำเสมอเมื่อผสมกับเบสแก่หรือกรดแก่
ความเข้มข้นของบัฟเฟอร์ได้รับอิทธิพลอย่างมากจากปริมาณของเบสหรือกรดในแต่ละสารละลาย สารละลายบัฟเฟอร์ที่มีความจุสูงสุดคือสารละลายที่มีกรดหรือเกลือในปริมาณมาก
ตัวอย่างเช่น CH3COOH และ CH3COONa มีความจุมากกว่า 2 โมลรวมกันของCH3COOH และ CH3COONa ซึ่งมีปริมาณเพียง 1 โมล
ในขณะเดียวกัน หากเนื้อหามีขนาดเล็ก ความจุของบัฟเฟอร์ก็เล็กเช่นกัน ดัชนีบัฟเฟอร์ที่มีระดับสูงจะทำงานได้อย่างมีประสิทธิภาพมากขึ้นในการทำให้กรดหรือเบสเป็นกลางก่อนที่จะมีการเปลี่ยนแปลงค่า pH อย่างมีนัยสำคัญ
นอกจากนี้ ความจุบัฟเฟอร์ยังได้รับผลกระทบจากอัตราส่วนของจำนวนโมลของกรด-เกลือหรือเบส-เกลือ แน่นอนว่าการเปรียบเทียบขนาดใหญ่ทำให้เกิดบัฟเฟอร์ที่มีความเข้มข้นมากเช่นกัน
ตัวอย่างเช่น CH3COOH และ CH3COONa ซึ่งมีอัตราส่วน 1:1 (ค่าเท่ากับ 1) มากกว่าCH3COOH และ CH3COONa ซึ่งมีอัตราส่วน 1:2 (ค่าจะกลายเป็น 0.5)
อ่าน: สูตรความหนาแน่น
สูตรสารละลายบัฟเฟอร์

โฆษณา
บัฟเฟอร์คำนวณอย่างไร? มีสูตรที่ต้องใช้เพื่อทำการคำนวณเหล่านี้ สูตรแบ่งออกเป็นสองสูตรคือบัฟเฟอร์กรดพิเศษและบัฟเฟอร์อัลคาไลน์
ขั้นแรก สูตรสำหรับสารละลายบัฟเฟอร์กรดมีดังนี้:

Ka หมายถึงค่าคงที่ของสมดุลกรด
V คือความจุซึ่งเป็นปริมาณของเบสคอนจูเกตที่อ่อนแอหรือปริมาณไอออน
ประการที่สอง สูตรสำหรับสารละลายบัฟเฟอร์อัลคาไลน์คือ:
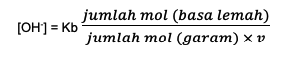
Kb เป็นค่าคงที่สมดุลฐาน
V คือวาเลนซ์ซึ่งเป็นปริมาณของกรดคอนจูเกตหรือปริมาณไอออนอ่อน
ตัวอย่างปัญหาการแก้ปัญหาบัฟเฟอร์และการอภิปราย

ต่อไปนี้คือตัวอย่างคำถามเพื่อให้คุณเข้าใจบัฟเฟอร์มากขึ้น:
1. CH โซลูชั่น3COOH 0.1 M, Ka (10-5) มากเท่ากับ 200 มล. ถูกเติมลงใน CH. สารละลาย3นอกจากนี้ 200 มล. ของ 0.1 M COONa แล้วค่า pH ของส่วนผสมคืออะไร?
ขั้นตอนแรกคือการคำนวณโมลของแต่ละสารละลายก่อน:
ไฝCH3COOH = m v = 0.1 200 = 20 mmol
ไฝCH3COONa = m v = 0.1 200 = 20 mmol
จากนั้น ตรงไปที่สูตรบัฟเฟอร์สำหรับบัฟเฟอร์กรด:

จากการคำนวณเหล่านี้ความเข้มข้นของ H. ไอออน+ ที่ทราบกันดีอยู่แล้วว่า จากนั้นป้อนการคำนวณเพื่อหาค่า pH กล่าวคือ:
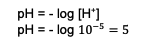
ดังนั้น pH ของส่วนผสมที่ได้คือ 5
2. เอ็นเอช. โซลูชั่น3 0.1 M Kb (10-5) มากถึง 400 มล. ผสมกับสารละลาย NH4Cl 0.1 M มากถึง 200 มล. กำหนด pH ของส่วนผสมที่ปรากฏเนื่องจากส่วนผสม!
ขั้นตอนแรกคือการหาโมลของสารละลาย ได้แก่ :
โมลของ NH3 = m v = 0.1 400 = 40 mmol
โมลของ NH4Cl = m v = 0.1 200 = 20 mmol
หลังจากนั้นใช้สูตรบัฟเฟอร์ฐานเพื่อกำหนดความเข้มข้นของ OH. ions– ซึ่งจะใช้ในการคำนวณค่า pH ในภายหลัง

จากนั้นให้ป้อนค่า pH ของส่วนผสมคือ:
pOH = – บันทึก [OH–] = 5 – บันทึก 4
pH = 14 – pOH
pH = 14 – (5 – log 4) = 9 + log 4
บทสรุป
บัฟเฟอร์เป็นสารละลายที่สามารถรักษาระดับ pH เริ่มต้นในช่วงหนึ่งหลังจากเติมสารละลายกรดหรือเบสเล็กน้อย มี 2 ประเภท ได้แก่ บัฟเฟอร์กรดจากกรดอ่อนและเกลือและบัฟเฟอร์อัลคาไลน์จากเบสอ่อนและเกลือ
การเรียนรู้เกี่ยวกับสารละลายบัฟเฟอร์ที่มีหน้าที่ในชีวิตเป็นสิ่งสำคัญ ไม่เพียงแต่เข้าใจหลักการทำงาน แต่ยังรู้ค่า pH ของส่วนผสมของบัฟเฟอร์ที่ก่อตัวขึ้นและปฏิกิริยากรด-เบสเพื่อสร้างบัฟเฟอร์
X ปิด
โฆษณา
โฆษณา
X ปิด
