เคมีสัมพันธ์: แนวคิด ประเภท ปัญหาตัวอย่าง
กำลังโหลด...
แนวคิดเรื่องปริมาณสัมพันธ์เป็นวิทยาศาสตร์ในวิชาเคมีซึ่งเป็นพื้นฐานสำหรับการคำนวณความสัมพันธ์เชิงปริมาณของสารตั้งต้นและผลิตภัณฑ์ที่เกิดขึ้นในปฏิกิริยาเคมี มันขึ้นอยู่กับสมการของปฏิกิริยาและกฎพื้นฐาน
ลักษณะของปฏิกิริยาปริมาณสัมพันธ์คือไม่มีสารตกค้างจากสารตั้งต้นหรือปฏิกิริยาเนื่องจากถูกใช้จนหมด โดยทั่วไป เนื้อหานี้สอนในชั้นมัธยมศึกษาปีที่ 10 และมักจะออกมาในการสอบของโรงเรียนต่างๆ นี่คือคำอธิบายแบบเต็ม
รายการเนื้อหา
วัสดุเคมีปริมาณสัมพันธ์
การศึกษาปริมาณสัมพันธ์หมายถึงต้องเข้าใจสิ่งที่เกี่ยวข้องหลายประการ สิ่งเหล่านี้รวมถึงกฎพื้นฐานของเคมี แนวคิดในวิชาเคมีที่เกี่ยวข้องกันและประเภทของพวกมัน จำเป็นต้องมีคำถามฝึกหัดเพื่อให้ความเข้าใจที่พวกเขามีมากขึ้น
กฎพื้นฐานของเคมีสำหรับปริมาณสัมพันธ์
มีกฎพื้นฐาน 5 ข้อในวิชาเคมีที่จำเป็นต้องรู้เพื่อทำความเข้าใจปริมาณสัมพันธ์ รวมไปถึง:
1. กฎการอนุรักษ์มวล

ในปี ค.ศ. 1789 นักเคมีชื่อ Lavoisier ได้กำหนดกฎการอนุรักษ์มวล สาระสำคัญของกฎการอนุรักษ์มวลคือน้ำหนักรวมของสารจะยังคงเหมือนเดิม ทั้งก่อนและหลังปฏิกิริยาเคมี
เช่น มวลไม้ก่อนเผาด้วยมวลผลจากการเผาไม้ไม่เปลี่ยนแปลง กล่าวอีกนัยหนึ่ง มวลของสารหรือวัตถุที่ครอบครองก่อนและหลังเกิดปฏิกิริยาจะถูกอนุรักษ์ไว้
2. กฎหมายเปรียบเทียบคงที่

Joseph Proust เป็นผู้เชี่ยวชาญที่สร้างกฎสัดส่วนคงที่ในปี 1799 กฎข้อนี้ระบุว่าอัตราส่วนของน้ำหนักรวมของธาตุที่ประกอบเป็นสารประกอบเฉพาะจะไม่เปลี่ยนแปลงหรือคงที่
จากภาพประกอบ อัตราส่วนของมวลของสาร A และสาร B ที่มีอยู่ในสารละลายจะคงที่เสมอและไม่ได้รับผลกระทบจากปริมาตรของสารละลายเลย
3. กฎการเปรียบเทียบพหุคูณ

นอกจากนี้ กฎพื้นฐานของปริมาณสัมพันธ์ที่จำเป็นต้องเข้าใจคือกฎของอัตราส่วนพหุคูณที่ทำโดย John Dalton ในปี 1803 การเปรียบเทียบหลายรายการเป็นส่วนเสริมของกฎการเปรียบเทียบคงที่
กฎของสัดส่วนหลายสัดส่วนระบุว่าเมื่อองค์ประกอบ 2 ตัวรวมกันมากกว่า 2 สารประกอบ น้ำหนักรวมของมันคือ องค์ประกอบที่เป็นส่วนประกอบหนึ่งมีค่าคงที่ จากนั้นน้ำหนักรวมขององค์ประกอบส่วนประกอบอื่น ๆ จะเป็นจำนวนเต็ม เรียบง่าย.
4. กฎของเกย์ ลูซแซก
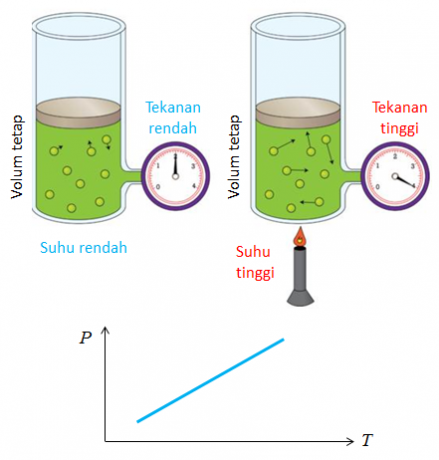
อีกชื่อหนึ่งของกฎหมายที่ค้นพบโดยโจเซฟ เกย์ ลุสแซกคือกฎหมายว่าด้วยอัตราส่วนของปริมาตร ข้อสรุปที่ได้จากกฎการเปรียบเทียบปริมาตรคืออุณหภูมิและความดันส่งผลต่อการเปลี่ยนแปลงของปริมาตรก๊าซ
5. สมมติฐานของ Avogadro
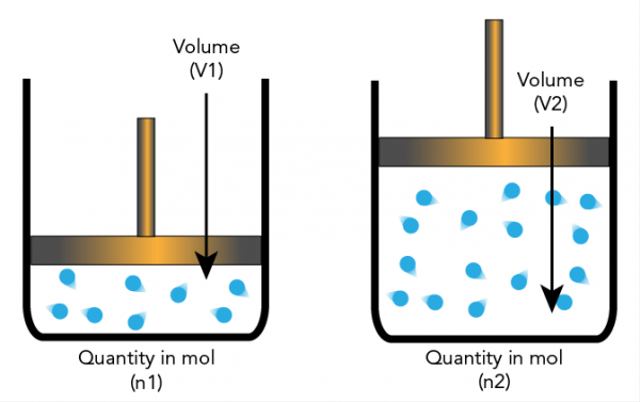
Amadeo Avogadro เสนอสมมติฐานว่าอนุภาคธาตุสามารถเป็นโมเลกุลและองค์ประกอบเพื่อไม่ให้เป็นอะตอมเสมอไป สิ่งนี้นำไปสู่คำอธิบายเพิ่มเติมเกี่ยวกับปริมาณสัมพันธ์ที่อิง
สมมติฐานของอาโวกาโดรระบุว่าหากอุณหภูมิและความดันมีจำนวนเท่ากัน อัตราส่วนของก๊าซที่มีปริมาตรเท่ากันจะมีจำนวนโมเลกุลเท่ากัน
อ่าน: วัสดุคอลลอยด์
แนวคิดทางเคมีที่ต้องทำความเข้าใจในสารสัมพันธ์
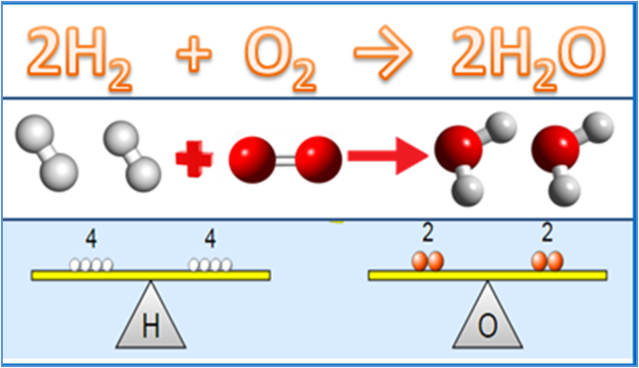
ไม่เพียงแต่กฎพื้นฐานเท่านั้น สิ่งสำคัญอื่นๆ ที่เกี่ยวข้องอย่างใกล้ชิดกับวัสดุปริมาณสัมพันธ์เป็นแนวคิดในวิชาเคมี อย่างน้อยก็มี 4 แนวคิดที่ต้องทำความเข้าใจ ได้แก่ มวลอะตอมสัมพัทธ์ มวลโมเลกุลสัมพัทธ์ โมลาริตี และแนวคิดเรื่องโมล
1. มวลอะตอมสัมพัทธ์ (Ar)
ในวิชาเคมี คำย่อของมวลอะตอมสัมพัทธ์คือ Ar แนวคิดนี้หมายถึงน้ำหนักอะตอมรวมซึ่งกำหนดโดยเปรียบเทียบกับน้ำหนักรวมของอะตอมมาตรฐาน International Union of Pure and Applied Chemistry ใช้อะตอมของคาร์บอนเป็นมาตรฐานในการกำหนด
อะตอมของคาร์บอนหรือไอโซโทป C-12 ถูกเลือกเพราะมีนิวเคลียสที่เสถียรซึ่งเฉื่อยมากกว่าอะตอมประเภทอื่น เฉื่อยหมายถึงความต้านทานต่อปฏิกิริยาเคมีที่เกิดขึ้น
2. มวลโมเลกุลสัมพัทธ์ (นาย)
นอกจากนี้ยังมีแนวคิดเรื่องมวลโมเลกุลสัมพัทธ์เรียกย่อว่า Mr. แนวคิดของปริมาณสัมพันธ์ Mr คือน้ำหนักรวมของโมเลกุลที่มีการวัดโดยใช้หน่วยมวลอะตอม
โฆษณา
จากแนวคิดนี้ โมเลกุลต่างๆ ที่มีสารประกอบเดียวกันมีความเป็นไปได้ที่จะมีความแตกต่างในมวลโมเลกุลเนื่องจากไอโซโทปที่พวกมันมีอยู่นั้นมาจากองค์ประกอบที่แตกต่างกัน
3. แนวคิดโมล
เคมีมีหน่วยบัญชีเพื่อลดความซับซ้อนของกระบวนการคำนวณคือโมล แนวคิดเรื่องโมลขึ้นอยู่กับจำนวนของอโวกาโดรเพื่อแทนจำนวนโมเลกุล อะตอม หรือไอออน ตามแนวคิดนี้ 1 โมลเท่ากับ 6.022 x 1023 อนุภาคของสาร
มวลของโมลหนึ่งสามารถกล่าวได้ว่าเทียบเท่ากับ Ar และ Mr ในหน่วยกรัม ตัวอย่างเช่น น้ำหนักรวมของมวลโมลาร์ของคาร์บอน 12 กรัม/โมล เท่ากับ Ar ของคาร์บอน 12 amu
4. โมลาริตี
โมลาริตีเป็นแนวคิดในวิชาเคมีที่ระบุจำนวนโมลของตัวถูกละลายในตัวทำละลาย 1 ลิตร กล่าวอีกนัยหนึ่งโมลาริตีหมายถึงความเข้มข้นที่มีอยู่ในปริมาณของตัวถูกละลายต่อหน่วยปริมาตร
อ่าน: สูตรโมลาริตี
ประเภทของสารสัมพันธ์ทางเคมี

โปรดทราบว่ามีปริมาณสัมพันธ์ 3 ประเภท ได้แก่ ปฏิกิริยา ก๊าซและสารประกอบหรือองค์ประกอบ นี่คือคำอธิบายแบบเต็ม:
1. ปริมาณสัมพันธ์ของปฏิกิริยา
คำจำกัดความของปริมาณสัมพันธ์ของปฏิกิริยาเป็นแนวคิดประเภทหนึ่งที่เน้นความสัมพันธ์เชิงปริมาณระหว่างสารที่มีอยู่ในปฏิกิริยาเคมีโดยเฉพาะ แนวคิดนี้ใช้เพื่อปรับสมดุลสมการเคมีที่เกิดขึ้น
จากคำอธิบายนี้ อาจกล่าวได้ว่าสารที่มีส่วนร่วมในปฏิกิริยาเคมีส่งผลต่อความสัมพันธ์เชิงปริมาณระหว่างสารเหล่านี้
2. ปริมาณสัมพันธ์ของแก๊ส
ถัดไป gas stoichiometry หมายถึงแนวคิดของปฏิกิริยาเคมีที่มีก๊าซอยู่ ก๊าซที่ความดัน อุณหภูมิ และปริมาตรหนึ่งถือเป็นก๊าซในอุดมคติ แก๊สประกอบด้วยอนุภาคเพียงชุดเดียวซึ่งมีการเคลื่อนที่แบบสุ่มและไม่มีปฏิกิริยาโต้ตอบ
สมการก๊าซในอุดมคติแสดงโดย P.V = n ร.ท. ในสูตร P คือความดันเป็น atm V คือปริมาตรของแก๊สเป็นลิตร n คือจำนวนโมล T คืออุณหภูมิ 273 K และ R คือแก๊ส 0.082 L atm/mol K
3. สารสัมพันธ์เชิงปริมาณ
คำจำกัดความของปริมาณสัมพันธ์ของสารประกอบหรือองค์ประกอบเป็นแนวคิดที่แสดงความสัมพันธ์เชิงปริมาณของน้ำหนักรวมหรือปริมาณของสารที่องค์ประกอบในสารประกอบเฉพาะมี
แนวคิดนี้มักใช้เพื่ออธิบายน้ำหนักรวมของไฮโดรเจนและไนโตรเจนที่รวมกันเป็นแอมโมเนียเชิงซ้อน
อ่าน: สูตรความหนาแน่น
ตัวอย่างปัญหาและการอภิปรายปริมาณสัมพันธ์

วิธีแก้ปัญหาที่เกี่ยวข้องกับปริมาณสัมพันธ์ ต่อไปนี้เป็นตัวอย่างคำถามและการอภิปรายเพื่อให้เข้าใจได้ง่ายขึ้น:
1. จงหาจำนวนอะตอมที่มีอยู่ใน 2 โมลของ H2โอ้!
ควรสังเกตว่า H2O มีอะตอม 2 H และ 1 O อะตอม จากนั้นสารละลายจะกลายเป็น:
จำนวนอะตอม H = 2 2 โมล 6.02 1023 อะตอม/โมล = 24.08 1023 อะตอม. ดังนั้นจำนวนอะตอมที่มีอยู่ใน 2 โมลของ H คือ 24.08 1023.
ทีนี้ลองนับจำนวนอะตอมที่อะตอม O เป็นเจ้าของ กล่าวคือ:
จำนวนอะตอมของ O = 1 2 โมล 6.02 1023 อะตอม/โมล = 12.04 1023 อะตอม. จากการคำนวณเหล่านี้จะเห็นได้ว่าจำนวนอะตอมใน 2 โมลของ O คือ 12.04 1023.
2. คำนวณน้ำหนักหรือมวลรวมของ C. 2 โมล6ชม12อู๋6 (กลูโคส)! เป็นที่ทราบกันดีอยู่แล้วว่าผลรวมของ Ar C = 12, O = 16 และ H = 1
การแก้ไขปัญหา:
จากคำถามจะเห็นข้อมูลดังนี้
n = 2 โมล
นายซี6ชม12อู๋6 = (6 อาค) + (12 1) + (6 16)
= 180
ถัดไป การคำนวณจะกลายเป็น:
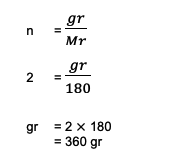
ดังนั้นน้ำหนักรวมของกลูโคส 2 โมลหรือ C6ชม12อู๋6 มากถึง 360 กรัมตามการคำนวณเหล่านี้
หัวข้อสำคัญอย่างหนึ่งในวิชาเคมีคือปริมาณสัมพันธ์ซึ่งเป็นแนวคิดพื้นฐานของการคำนวณเพื่อหาความสัมพันธ์เชิงปริมาณระหว่างสมการเคมีและสูตร ยังต้องเข้าใจแนวคิดอื่นๆ อีกหลายประการในวิชาเคมีเนื่องจากเกี่ยวข้องกับปริมาณสัมพันธ์
X ปิด
โฆษณา
โฆษณา
X ปิด
