HEAT: สูตร ประเภท ปัญหาตัวอย่าง (สรุป)
กำลังโหลด...
สูตรความร้อนเป็นสิ่งที่คุ้นเคยในบทเรียนฟิสิกส์ ความร้อนเป็นพลังงานรูปแบบหนึ่งที่วัตถุสามารถรับหรือปลดปล่อยออกมาได้ ความร้อนมีหน่วยที่เรียกว่าจูลส์หรือแคลอรี
ความร้อนสามารถตีความได้ว่าเป็นพลังงานความร้อนที่ครอบครองโดยสารบางชนิด และสามารถตรวจจับได้โดยการวัดอุณหภูมิของวัตถุ จะเห็นการประคบร้อนกับน้ำอุ่นที่เปิดทิ้งไว้ ค่อยๆ เย็นลง (ไม่อุ่นแล้ว) เพราะความร้อนถูกปล่อยจากน้ำสู่อากาศ
รายการเนื้อหา
ความหมายของแคลอรี่

ความร้อนเป็นพลังงานที่สามารถเคลื่อนที่จากวัตถุที่มีอุณหภูมิสูงกว่าไปยังวัตถุที่มีอุณหภูมิต่ำกว่าเมื่อวัตถุทั้งสองสัมผัสกันหรือถูกนำมารวมกัน วัตถุสองชิ้นที่มีอุณหภูมิต่างกันจะทำให้ความร้อนไหลและเคลื่อนที่
ตัวอย่างเช่น เมื่อคุณผสมน้ำร้อนกับน้ำเย็น น้ำที่รวมกันจะกลายเป็นน้ำอุ่น คุณต้องเข้าใจด้วยว่าอุณหภูมิและความร้อนเป็นสองสิ่งที่แตกต่างกัน อุณหภูมิเป็นค่าที่สามารถวัดได้ด้วยเทอร์โมมิเตอร์ ในขณะที่ความร้อนคือพลังงานที่ไหล
ตามระบบสากล (SI) หรือ MKS หน่วยความร้อนคือจูล (J) ในขณะที่ตาม CGS หน่วยความร้อนคือ erg สำหรับอาหารหลายประเภท ความร้อนใช้หน่วยแคลอรี
หนึ่งแคลอรี่หมายถึงปริมาณพลังงานความร้อนที่จำเป็นในการทำให้อุณหภูมิของน้ำ 1 กรัมสูงขึ้นเป็น 1 องศาเซลเซียส ดังนั้นจึงสรุปได้ว่า 1 แคลอรี = 4.184 จูล หรือโดยทั่วไปจะปัดขึ้นเป็น 4.2 เจ
สูตรแคลอรี่
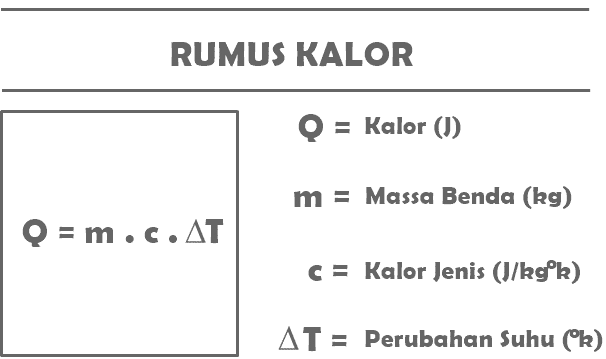
ตามคำจำกัดความของความร้อนที่คุณได้อ่านข้างต้น ต่อไปนี้เป็นสูตรบางส่วนที่ได้รับการสรุปเกี่ยวกับวัสดุความร้อนในวิชาฟิสิกส์
1. สูตรการถ่ายเทความร้อน
คิว = ม. ค. ตู่
กับ:
Q = ปริมาณความร้อนที่ได้รับหรือปล่อยออกมาจากวัตถุบางอย่าง (J)
m = มวลของวัตถุที่ได้รับหรือปล่อยความร้อน (กก.)
c = ความร้อนจำเพาะของสาร (J/kg°C)
T = การเปลี่ยนแปลงของอุณหภูมิ (°C)
2. สูตรความร้อนจำเพาะ
เกณฑ์มาตรฐานของสูตรนี้คือสูตรการถ่ายเทความร้อน โดยเอาธาตุ c (ความร้อนจำเพาะของสาร) มาคำนวณทางคณิตศาสตร์ตามปกติ
c = Q / (ม. ต)
กับ:
c = ความร้อนจำเพาะของสาร (J/kg°C)
Q = ปริมาณความร้อนที่ได้รับหรือปล่อยออกมาจากวัตถุบางอย่าง (J)
m = มวลของวัตถุที่ได้รับหรือปล่อยความร้อน (กก.)
T = การเปลี่ยนแปลงของอุณหภูมิ (°C)
3. สูตรความจุความร้อน
C = Q / T
กับ:
C = ความจุความร้อน (J/°K)
Q = ความร้อนมาก (J)
T = การเปลี่ยนแปลงของอุณหภูมิ (เคลวิน / K)
4. สูตรการหาความจุความร้อน
C = ม. ค
กับ:
C = ความจุความร้อน (J/°K)
m = มวลของวัตถุที่ได้รับหรือปล่อยความร้อน (กก.)
c = ความร้อนจำเพาะของสาร (J/kg°K)
5. ความร้อนของการหลอมเหลวและสูตรไอ
สูตรความร้อนหลอมเหลวมีดังนี้
คิว = ม. หลี่
สูตรความร้อนของไอมีดังนี้
คิว = ม. ยู
กับ:
Q = ความร้อนมาก (J)
m = มวลของวัตถุ (กก.)
L = ความร้อนของการหลอมเหลว (J/kg)
U = ความร้อนไอของสาร (J/kg)
อ่าน: อุณหพลศาสตร์
ประเภทของแคลอรี่

ความร้อนมีหลายประเภทที่แตกต่างกันไปตามกระบวนการทำงานในสารเฉพาะ ด้านล่างนี้คือประเภทของความร้อนที่คุณต้องเข้าใจเพื่อให้สามารถนำไปใช้ในชีวิตประจำวันได้
1. ความร้อนของการก่อตัว (ΔHf)
ความร้อนของการก่อตัวคือความร้อนที่ผลิตหรือจำเป็นในการสร้าง 1 โมลของสารประกอบในองค์ประกอบของมัน เช่น ก๊าซ ซึ่งเขียนโดยใช้สูตรโมเลกุล ตัวอย่างความร้อนของการก่อตัวคือ C12, อ้อ2, บรา2, ชม2.
2. ความร้อนของการสลายตัว (ΔHd)
ความร้อนจากการสลายตัวเป็นรูปแบบของความร้อนที่เกิดขึ้นหรือจำเป็นต้องสลายสารประกอบ 1 โมลให้เป็นองค์ประกอบอื่น
3. ความร้อนจากการเผาไหม้ (ΔHc)
ความร้อนจากการเผาไหม้คือความร้อนที่ได้รับหรือจำเป็นในการเผาผลาญสาร 1 โมล เช่น ธาตุหรือสารประกอบ
4. ความร้อนของการทำให้เป็นกลาง (ΔHn)
ความร้อนของการวางตัวเป็นกลางคือชนิดของความร้อนที่ได้รับหรือจำเป็นในการสร้าง H. หนึ่งโมล2O จากปฏิกิริยาระหว่างกรดกับเบส ความร้อนนี้เป็นปฏิกิริยาคายความร้อนเนื่องจากมีอุณหภูมิเพิ่มขึ้น
5. ความร้อนของการละลาย (ΔHs)
ความร้อนของการละลายคือชนิดของความร้อนที่ผลิตหรือต้องการเพื่อละลายสาร 1 โมลที่เดิมเป็นของแข็งไปเป็นสารละลาย
อ่าน: สูตรความหนาแน่น
ความจุความร้อนและความร้อนจำเพาะ
คุณต้องรู้ด้วยว่าความร้อนสามารถไหลในสารสองชนิดที่มีอนุภาคของสสารต่างกันและอุณหภูมิเปลี่ยนแปลงต่างกัน ตัวอย่างเช่น เมื่อน้ำและน้ำมันถูกทำให้ร้อนถึงอุณหภูมิเดียวกัน อุณหภูมิของน้ำมันจะเปลี่ยนแปลงมากกว่าอุณหภูมิของน้ำที่เปลี่ยนแปลง
สิ่งนี้สามารถเกิดขึ้นได้เพราะมีความร้อนต่างกันในวัตถุสองชิ้นที่นำมารวมกันหรือประกอบเข้าด้วยกัน ความร้อนจำเพาะ คือ ปริมาณความร้อนที่ต้องใช้ในการเพิ่มอุณหภูมิจากมวล 1 กิโลกรัมเป็น 1°C หน่วยคือแคลอรี/กรัม°เซลเซียส หรือ J/กก°C
สารแต่ละชนิดมีความร้อนจำเพาะและมีความแตกต่างกัน ในขณะเดียวกัน แนวคิดเรื่องความจุความร้อนคือปริมาณความร้อนที่ต้องการหรือดูดซับเพื่อให้อุณหภูมิของวัตถุสูงขึ้น 1°C
เปลี่ยนความร้อน
ในการใช้งาน สูตรความร้อนทำงานโดยใช้หลักการที่เปลี่ยนสารสองชนิดที่นำมารวมกันหรือสัมผัสกัน ด้านล่างนี้คือการเปลี่ยนแปลงความร้อนที่เกิดขึ้นเมื่อมีสารที่ประกอบเข้าด้วยกันหรือนำมารวมกัน
1. ความร้อนสามารถเปลี่ยนอุณหภูมิของสารได้
วัตถุพื้นฐานแต่ละชิ้นมีอุณหภูมิต่ำกว่าศูนย์สัมบูรณ์ ดังนั้นวัตถุต้องมีความร้อน เนื้อหานี้จะกำหนดว่าอุณหภูมิของวัตถุมีความร้อนเท่าใด
เมื่อวัตถุได้รับความร้อนก็จะได้ความร้อนเพิ่มขึ้น อุณหภูมิจะเพิ่มขึ้นหรือเพิ่มขึ้น ในทางกลับกัน หากวัตถุถูกทำให้เย็นลง ความร้อนก็จะถูกปล่อยออกมาและทำให้อุณหภูมิลดลง
2. ความร้อนสามารถเปลี่ยนสารได้

ในวัตถุบางประเภท เมื่อได้รับความร้อนในบางหน่วย วัตถุสามารถเปลี่ยนแปลงสถานะได้ ตัวอย่างเช่น หากน้ำแข็งได้รับความร้อน (ถูกทำให้ร้อน) น้ำแข็งจะเปลี่ยนรูปแบบจากของแข็งเป็นของเหลวหรือแม้แต่ก๊าซ
หากกระบวนการให้ความร้อนเกิดขึ้นอย่างต่อเนื่อง นั่นคือสิ่งที่ทำให้น้ำเปลี่ยนรูปแบบกลับคืนสู่สสาร สิ่งนี้เกิดขึ้นเมื่อวัตถุที่กำลังจะเปลี่ยนรูปแบบเคลื่อนที่จากจุดของของเหลวไปยังจุดหลอมเหลวของวัตถุ
ประเภทของการถ่ายเทความร้อน
หลังจากอธิบายคำจำกัดความ ประเภท สูตรของความร้อน การเปลี่ยนแปลงของความร้อนแล้ว คุณสามารถสรุปได้ว่าความร้อนสามารถเคลื่อนที่ได้เมื่อสัมผัสหรือสัมผัสกับวัตถุอื่นๆ ต่อไปนี้เป็นการถ่ายเทความร้อนบางประเภท
1. การนำ

การถ่ายเทความร้อนโดยการนำเกิดขึ้นเมื่อผ่านสารตัวกลาง เช่น โลหะ แต่ไม่ได้ตามด้วยการเคลื่อนที่ของอนุภาคในสารอย่างถาวร ตัวอย่างเช่น เมื่อคุณให้ความร้อนปลายด้านหนึ่งของโลหะ ปลายอีกด้านของโลหะก็จะร้อนเช่นกัน
นี่เป็นเพราะการนำความร้อนจากอุณหภูมิสูงไปสู่อุณหภูมิที่ต่ำกว่า ปลายโลหะที่ถูกทำให้ร้อนจะทำให้อนุภาคโลหะสร้างการสั่นสะเทือนในอนุภาคอื่นๆ ที่เชื่อมต่ออยู่
ดังนั้นอนุภาคโลหะทั้งหมดจะสั่นสะเทือนแม้ว่าจะมีความร้อนเพียงด้านเดียวของโลหะ ซึ่งทำให้เกิดการถ่ายเทความร้อน อีกตัวอย่างหนึ่งคือเมื่อไอเสียของรถจักรยานยนต์ร้อนเมื่อเปิดมอเตอร์
การนำดอกไม้ไฟยังเกิดขึ้นเมื่อคุณถือดอกไม้ไฟบนกองไฟ จับฝาหม้อที่รู้สึกร้อนในระหว่างขั้นตอนการปรุงอาหาร เนยที่ละลายเมื่อถูกความร้อน และอื่นๆ สูตรการถ่ายเทความร้อนสำหรับการนำมีดังนี้
อัตราความร้อน = Q/t = kA ที / x
2. การพาความร้อน
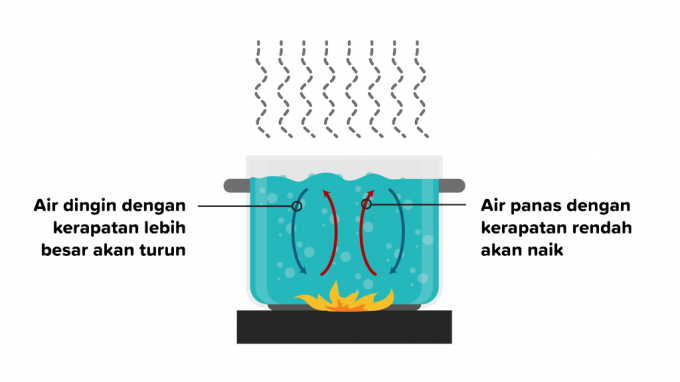
การพาความร้อนคือการถ่ายเทความร้อนที่ความร้อนไหลผ่านสารและตามด้วยการเคลื่อนที่ของส่วนต่างๆ ของสาร การถ่ายเทความร้อนโดยการพาความร้อนสามารถเกิดขึ้นได้ในของเหลวหรือก๊าซ ดังนั้นการพาความร้อนจึงแบ่งออกเป็นสองส่วนดังนี้
ก. การพาความร้อนทางวิทยาศาสตร์
การพาความร้อนคือการถ่ายเทความร้อนที่เกิดขึ้นเนื่องจากการลอยตัวโดยไม่มีปัจจัยภายนอกและได้รับอิทธิพลจากวัตถุประเภทต่างๆ กรณีตัวอย่างคือ เมื่อทำน้ำร้อน ความหนาแน่นของอนุภาคน้ำร้อนจะเคลื่อนออกจากไฟ จากนั้นสารน้ำที่มีอุณหภูมิต่ำกว่าจะเข้ามาแทนที่
ข. การพาความร้อนแบบบังคับ
โฆษณา
การพาความร้อนคือการถ่ายเทความร้อนที่เกิดจากอิทธิพลของปัจจัยภายนอก เช่น ความดัน เพื่อให้การถ่ายเทเกิดขึ้นโดยเจตนาหรือบังคับ นั่นคือความร้อนถูกบังคับให้ย้ายไปที่ใดที่หนึ่งเพราะความช่วยเหลือ
ตัวอย่างกรณีต่างๆ ได้แก่ พัดลมที่ผลิตอากาศเย็นไปยังสถานที่ที่รู้สึกร้อน ระบบระบายความร้อนเครื่องยนต์บนหม้อน้ำรถยนต์ เป็นต้น
การพาความร้อนแบบอื่นเกิดขึ้นเมื่อทำน้ำร้อนซึ่งมีการเคลื่อนตัวของน้ำขึ้นและลง เมล็ดถั่วเขียว ที่ขึ้นๆ ลงๆ เมื่อถูกต้ม กระบวนการของลมบกและทะเล การเคลื่อนตัวของบอลลูนลมร้อน ปล่องควัน โรงงาน.
สูตรการถ่ายเทความร้อนโดยการพาความร้อนมีดังนี้
อัตราความร้อน = Q/t = hA ตู่
3. รังสี

การแผ่รังสีคือการถ่ายเทความร้อนที่ไม่ต้องการสารตัวกลางหรือตัวกลาง การถ่ายเทความร้อนในรังสีไม่เหมือนกับการนำและการพาความร้อน การเคลื่อนตัวของรังสีไม่ได้ทำให้สารทั้งสองสัมผัสหรือพบกันเสมอไป เพราะความร้อนสามารถถ่ายเทได้แม้จะไม่มีตัวกลางก็ตาม
กล่าวคือ ความร้อนจะแผ่ออกไปทุกทิศทุกทางโดยแหล่งความร้อนนั้นเอง แล้วไหลไปทุกทิศทุกทางที่สามารถทำได้ โดยพื้นฐานแล้ว วัตถุทั้งหมดสามารถปล่อยและดูดซับรังสีความร้อนได้ แต่ปริมาณจะขึ้นอยู่กับอุณหภูมิและสีของสาร
วัตถุที่ร้อนกว่าอุณหภูมิรอบ ๆ ตัวก็จะยิ่งแผ่ความร้อนออกไปยังบริเวณโดยรอบมากขึ้นเท่านั้น ดังนั้นหากพื้นที่ผิวของวัตถุร้อนมากกว่า ความร้อนที่แผ่ออกมาก็จะร้อนขึ้น
ตัวอย่างเคสกัมมันตภาพรังสีในชีวิตประจำวันคือเมื่อก่อกองไฟจะรู้สึกอบอุ่น เนื่องจากแหล่งกำเนิดไฟอยู่ในระยะหนึ่ง รังสีจะรู้สึกได้เมื่อฝ่ามืออุ่นขึ้นเมื่อเข้าใกล้ ด้วยไฟ สูตรความร้อนสำหรับรังสีมีดังนี้
อัตราความร้อน = Q/t = eσAT4
4. การแยกความร้อน

ความร้อนมีคุณสมบัติในการถ่ายเทได้ง่าย คุณสามารถป้องกันไม่ให้การเคลื่อนไหวเกิดขึ้น ไม่ว่าจะเป็นการนำ การพา และการแผ่รังสี ตัวอย่างเช่นโดยการแยกห้อง กระติกน้ำร้อนสามารถรักษาอุณหภูมิของน้ำให้ร้อนหรืออุ่น เพื่อป้องกันการถ่ายเทความร้อน
อ่าน: สารแก๊ส
ตัวอย่างปัญหาแคลอรี่

สูตรความร้อนเป็นวิธีที่คุณสามารถใช้ในการทำงานกับตัวอย่างคำถามต่อไปนี้!
1. ตัวอย่างคำถาม 1
วัตถุมีอุณหภูมิ 5°C และดูดซับความร้อนได้ 1500 J อุณหภูมิของวัตถุเปลี่ยนเป็น 32°C คำนวณความจุความร้อนของวัตถุ!
วิธีการแก้:
Q = 1500 J
T = 32°C – 5°C = 27°C = 300°K
C = Q / T
C=1500/300
C = 5 J/°K
2. ตัวอย่างคำถาม 2
คำนวณความร้อนที่จำเป็นในการให้ความร้อนกับน้ำ 5 กก. ที่อุณหภูมิ 25°C ถึง 105°C หากทราบว่าความร้อนจำเพาะของน้ำคือ 1,000 J/kg°C!
วิธีการแก้:
ม. = 5 กก.
c = 1,000 J/กก.°C
T = 105 °C – 25 °C = 80 °C
คิว = ม. ค. ตู่
ถาม = 5. 1000. 80
Q = 400,000 J
3. ตัวอย่างคำถามที่ 3
ถ้าน้ำมีมวล 3 กก. และถูกทำให้ร้อนตั้งแต่ 30°C ถึง 100°C และความร้อนจำเพาะของมันคือ 1 J/g°C ให้คำนวณปริมาณความร้อนที่จำเป็นสำหรับน้ำ!
วิธีการแก้:
ม. = 3 กก.
c = 1 g/°C = 1,000 J/kg°C
T = 100°C – 30°C = 70°C
คิว = ม. ค. ตู่
ถาม = 3 1000. 70
คิว = 210,000 J
4. ตัวอย่างคำถาม 4
ของเหลวมีมวล 5 กก. ของเหลวต้องการความร้อน 200,000 J และให้ความร้อนตั้งแต่ 20°C ถึง 80°C คำนวณความร้อนจำเพาะของของเหลว!
วิธีการแก้:
ม. = 5 กก.
Q = 200,000 J
T = 80°C – 20°C = 60°C
c = Q/m. ตู่
ค = 200,000 / 5. 60
c = 200,000 / 300
c = 666.67 J/kg°C
5. ตัวอย่างคำถามที่ 5
อลูมิเนียมมีมวล 5 กก. อุณหภูมิเริ่มต้นคือ 25 องศาเซลเซียส หากอะลูมิเนียมได้รับความร้อน 250,000 J และความร้อนจำเพาะของมันคือ 900 J/kg°C ให้คำนวณอุณหภูมิสุดท้ายของอะลูมิเนียม!
วิธีการแก้:
ม. = 5 กก.
Q = 250,000 J
c = 900 J/kg°C
ตู่1 = 25 องศาเซลเซียส
คิว = ม. ค. ตู่
250.000 = 5. 900. (T2 – 25)
ตู่2 – 25 = 250.000 / 5. 900
ตู่2 – 25 = 250.000 / 4.500
ตู่2 – 25 = 55,56
ตู่2 = 55.56 + 25 = 80.56°C
6. ตัวอย่างคำถามที่ 6
มีน้ำ 300 กรัมที่อุณหภูมิ 25 ° C จะถูกทำให้ร้อนด้วยพลังงาน 1,500 แคลอรี่ ถ้าความร้อนจำเพาะของน้ำเท่ากับ 1 cal/g°C ให้คำนวณอุณหภูมิของน้ำหลังจากที่ทำให้ร้อนแล้ว!
วิธีการแก้:
ม. = 300 กรัม
ตู่1 = 25 องศาเซลเซียส
c = 1 cal/g°C
Q = 1,500 แคล
คิว = ม. ค. ตู่
1.500 = 300. 1. (T2 – 25)
ตู่2 – 25 = 1500 / 300. 1
ตู่2 – 25 = 5
ตู่2 = 5 + 25 = 30°C
7. ตัวอย่างคำถามที่ 7
มีน้ำ 300 กรัมให้อุ่นจาก 40°C ถึง 65°C ถ้าความร้อนจำเพาะของน้ำคือ 1 cal/g°C หรือ 4,200 J/kg°K ให้คำนวณดังนี้
- ได้รับความร้อนเป็นจำนวนมากในแคลอรี่
- รับความร้อนเท่าใดในจูลส์
วิธีการแก้:
ม. = 300 ก. = 0.3 กก.
T = 65 – 40 = 25 องศาเซลเซียส
c = 1 cal/g°C = 4,200 J/kg°K
- แคลอรี่เป็นแคลอรี่
คิว = ม. ค. ตู่
ถาม = 300 1. 25
Q = 7,500 แคลอรี่
- ความร้อนในจูลส์
คิว = ม. ค. ตู่
คิว = 0.3 4.200. 25
Q = 31,500 แคลอรี = 132,300 จูล
จากคำอธิบายข้างต้น สูตรความร้อนไม่เพียงหมุนรอบการปล่อยและความต้องการ ความร้อนแต่มีการเปลี่ยนแปลงของความร้อน การถ่ายเทความร้อน แม้กระทั่งความร้อนจำเพาะของสารแต่ละชนิดนั้น ต่างกันไป. มีความสุขในการฝึกฝนและฉันหวังว่าบทความนี้จะเป็นประโยชน์!
X ปิด
โฆษณา
โฆษณา
X ปิด
