วัสดุจำนวนควอนตัม: ชนิด ตัวอย่างปัญหา (สรุป)
กำลังโหลด...
เมื่ออธิบายง่ายๆ เลขควอนตัมคือตัวเลขที่อธิบายตำแหน่งของอิเล็กตรอนและระดับพลังงานหรือ ระยะห่างจากนิวเคลียสของอะตอมในคราวเดียว รูปร่างของออร์บิทัล ทิศทางของออร์บิทัล และการหมุนของอิเล็กตรอนที่อยู่ในแบบจำลองอะตอมเครื่องกล ควอนตัม
แต่ละอะตอมมีวงโคจรและออร์บิทัลของอะตอมมีระดับพลังงานต่างกัน ระดับพลังงานของวงโคจรเดียวกันจะมีระดับพลังงานต่างกันหากอะตอมต่างกัน ดังนั้นวงโคจร 1 วินาทีของไฮโดรเจนจึงแตกต่างกันในระดับพลังงานจากวงโคจร 1 วินาทีสำหรับฮีเลียม
รายการเนื้อหา
ความหมายของตัวเลขควอนตัม

ในฟังก์ชันคลื่น ตัวเลขนี้มีความหมายพิเศษในการอธิบายสถานะของสถานการณ์ควอนตัม ตัวเลขเหล่านี้สามารถอธิบายสถานะของอิเล็กตรอนในอะตอมได้ ในปี 1926 Erwin Schrodinger เสนอทฤษฎีกลศาสตร์ควอนตัม
ทฤษฎีนี้อธิบายโครงสร้างของอะตอม แบบจำลองอะตอมเชิงกลควอนตัมนี้แสดงเป็นสมการทางคณิตศาสตร์ กล่าวคือ สมการคลื่น การแก้สมการของอะตอมไฮโดรเจนทำให้เกิดฟังก์ชันคลื่นหรือออร์บิทัลของอะตอม
การโคจรของอะตอมนี้จะอธิบายสถานการณ์ของจำนวนอิเล็กตรอนควอนตัมในอะตอม ฟังก์ชันกำลังสองของคลื่นหมายความว่ามีความเป็นไปได้สูงที่จะได้อิเล็กตรอนในปริมาตรที่กำหนดรอบนิวเคลียสของอะตอม
เช่นเดียวกับหลักการความไม่แน่นอนของไฮเซนเบิร์ก ตำแหน่งของอิเล็กตรอนในอะตอมไม่สามารถกำหนดได้ สิ่งที่สามารถทราบได้คือตำแหน่งที่มีแนวโน้มว่าจะพบอิเล็กตรอนมากที่สุด
ประเภทของตัวเลขควอนตัม
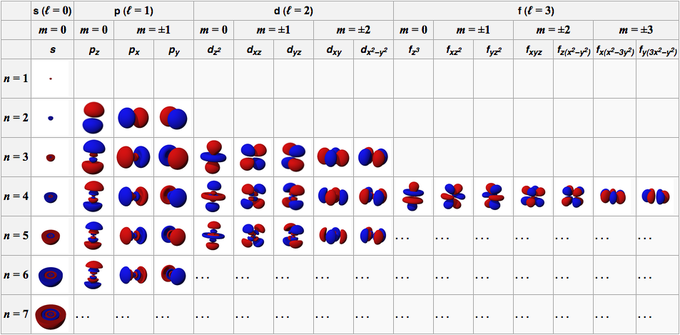
การโคจรของอะตอมเกิดจากฟังก์ชันคลื่นที่ประกอบเป็นออร์บิทัล ภายใต้สภาวะทั่วไป ลักษณะการโคจรของอะตอมจะอธิบายด้วยตัวเลขสี่ตัว ได้แก่ n, l, m และ s
1. หมายเลขควอนตัมหลัก (n)
ตัวเลขนี้ประกอบด้วยจำนวนเต็มบวกที่เริ่มต้นจาก 1 (หนึ่ง) ทำให้ค่าของ n คือ 1, 2, 3, 4, 5 เป็นต้น ตัวเลขนี้หมายถึงเปลือกที่โคจรอยู่ในอะตอม
2. หมายเลขควอนตัม Azimuth (l)
ตัวเลขนี้ประกอบด้วยจำนวนเต็มบวกเริ่มต้นจาก 0 (ศูนย์) ทำให้ค่าของ l 0, 1, 2, 3, 4, 5 และอื่นๆ ตัวเลขเหล่านี้มีเครื่องหมายของตัวเอง 0 คือวงโคจรของ s, 1 คือวงโคจรของ p, 2 คือวงโคจร d และ 3 คือวงโคจรของ f
3. เลขควอนตัมแม่เหล็ก (ม.)
ตัวเลขนี้ประกอบด้วยจำนวนเต็มที่ตั้งแต่ 0 (ศูนย์) ถึง +/- 1 ดังนั้นค่าตัวเลขสำหรับแต่ละออร์บิทัลจึงไม่เท่ากัน สำหรับ s ออร์บิทัล แล้ว m เป็น 0 เพราะอยู่ใน s ออร์บิทัล แล้ว l เป็น 0 อย่างไรก็ตาม สำหรับ d orbitals โดยที่ l คือ 2 แล้ว m คือ -2, -1, 0, 1 และ 2
4. หมุนหมายเลขควอนตัม
หากตัวเลขก่อนหน้าระบุทิศทางของออร์บิทัล ตัวเลขนี้จะอธิบายการหมุนของอิเล็กตรอนที่มีค่า 1/2 และ -1/2
อ่าน: กลศาสตร์ควอนตัม
ออร์บิทัลและเลขควอนตัม
การโคจรของอะตอมแต่ละอันมีชุดตัวเลขควอนตัมสามจำนวนที่ไม่ซ้ำกัน ตัวเลขเหล่านี้เป็นเลขควอนตัมหลัก (n), แอซิมัทหรือโมเมนตัมเชิงมุม (l) และแม่เหล็ก (m) ตัวเลขทั้งสามนี้แสดงให้เห็นหลายสิ่งหลายอย่าง
สิ่งเหล่านี้รวมถึงการอธิบายระดับพลังงานของออร์บิทัล ขนาด รูปร่าง และทิศทางของการกระจายในแนวรัศมีที่เป็นไปได้ของออร์บิทัลของอะตอม จากนั้นจะมีเลขสปิน (s) ซึ่งเป็นตัวเลขที่บอกคุณถึงการหมุนของอิเล็กตรอนในวงโคจร
อะตอมออร์บิทัลรูปร่าง
ออร์บิทัลอะตอมมีสี่รูปแบบตามค่าเลขอาซิมุท รูปแบบการโคจรทั้งสี่มีดังนี้
1. s orbitals
s orbital เป็นออร์บิทัลที่มี l = 0 มีลักษณะเป็นทรงกลม โดยมีนิวเคลียสของอะตอมอยู่ตรงกลาง เนื่องจากทรงกลมมีทิศทางเดียวเท่านั้น ออร์บิทัล S ทั้งหมดจึงมีค่า m เพียงค่าเดียว นั่นคือ m = 0 การโคจรของ 1s มีความหนาแน่นหรือความหนาแน่นของอิเล็กตรอนสูงสุดในนิวเคลียสของอะตอม

ความหนาแน่นของอะตอมจะลดลงอย่างช้าๆ เมื่อมันเคลื่อนออกจากนิวเคลียสของอะตอม ออร์บิทัล 2s มีสองภูมิภาคที่มีความหนาแน่นของอิเล็กตรอนสูง จากทั้งสองภูมิภาค มีโหนดทรงกลม ซึ่งความน่าจะเป็นที่จะพบอิเล็กตรอนในบริเวณนั้นลดลงเป็นศูนย์
รูปแบบของจุดยอดโคจรที่เพิ่มขึ้นจะดำเนินต่อไปใน 4s, 5s และอื่น ๆ
2. หน้า. ออร์บิทัล
p orbital เป็นออร์บิทัลที่มี l = 1 รูปร่างเหมือนบอลลูนบิดตัวพร้อมกับสองแฉก กลีบอยู่ด้านตรงข้ามของนิวเคลียสของอะตอม นิวเคลียสของอะตอมอยู่ในระนาบของโหนด p orbital ระหว่างสองแฉกที่มีความหนาแน่นของอิเล็กตรอนสูง

p orbital มีการวางแนวเชิงพื้นที่สามประเภทคือ Px, Py และ Pz ดังนั้นจึงมีค่าที่เป็นไปได้สามค่าของ m คือ -1, 0, หรือ +1 ออร์บิทัลทั้งสามตั้งฉากกันบนแกน x, y และ z ในพิกัดคาร์ทีเซียน รูปร่าง ขนาด และพลังงานเท่ากัน
3. d orbital
d orbital เป็นออร์บิทัลที่มี l = 2 ออร์บิทัลนี้มีทิศทางที่แตกต่างกันห้าทิศทาง โดยให้ค่า m ที่เป็นไปได้ห้าค่า ได้แก่ -2, -1, 0, +1 หรือ +2 ออร์บิทัลทั้งสี่ ได้แก่ dxy, dxz, dyx และ d2-y2.
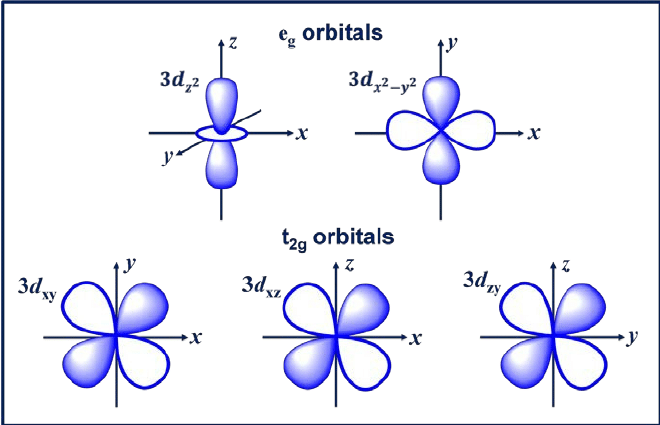
ออร์บิทัลเหล่านี้มีสี่แฉกที่มีรูปร่างเหมือนใบโคลเวอร์ลีฟ d orbital ถัดไปคือ dzwซึ่งมีสองแฉกหลักบนแกน z และส่วนรูปโดนัทอยู่ตรงกลาง
4. ฉ. ออร์บิทัล
f orbital เป็นออร์บิทัลที่มี l = 3 ออร์บิทัลนี้มีทิศทางเจ็ดประเภท เช่นเดียวกับที่มีค่า m ที่เป็นไปได้เจ็ดค่า (2l + 1 = 7) ออร์บิทัล f ทั้งหมดมีรูปร่างที่ซับซ้อนโดยมีจำนวนกลีบที่แตกต่างกัน
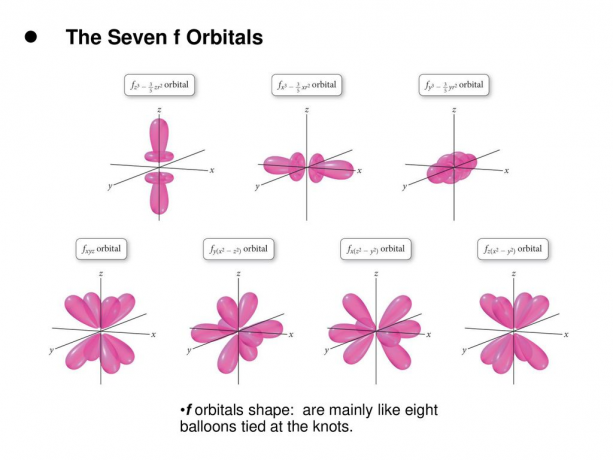
อ่าน: การกำหนดค่าอิเล็กตรอน
การกำหนดค่าอิเล็กตรอน
หลังจากที่คุณเข้าใจความสัมพันธ์ระหว่างการมีอยู่ของอิเล็กตรอนในอะตอมและออร์บิทัลในทฤษฎีอะตอมของกลศาสตร์ควอนตัมแล้ว ต่อไป คุณจะได้เรียนรู้เกี่ยวกับการกำหนดค่าอิเล็กตรอน วิธีจัดเรียงอิเล็กตรอนในออร์บิทัลในเปลือกอะตอม หลายอิเล็กตรอน
1. กฎของ Aufbau
โฆษณา
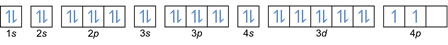
ในกฎข้อนี้ ระบุว่าจะต้องเติมอิเล็กตรอนจากระดับพลังงานต่ำไปสูง ระดับพลังงานของออร์บิทัลสามารถเห็นได้จากการจัดเรียงอะตอมในตารางธาตุขององค์ประกอบทางเคมี
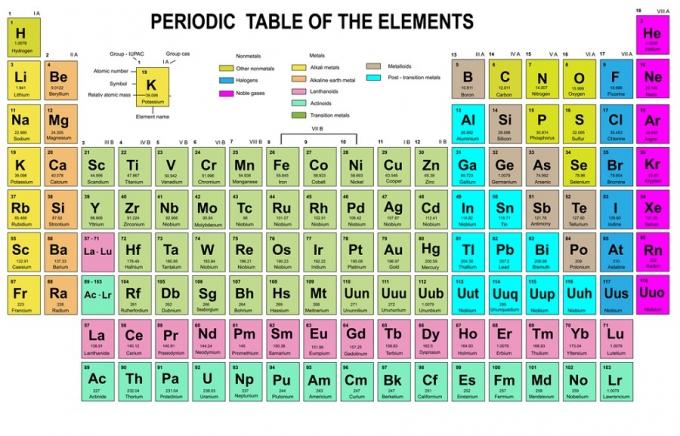
ในตาราง ด้านล่างซ้ายเขียนด้วยสีแดงซึ่งมี s บล็อก สีฟ้าสำหรับบล็อก d สีเหลืองสำหรับบล็อก p และสีเขียวสำหรับบล็อก f ในขณะที่แต่ละแถวเป็นสกิน
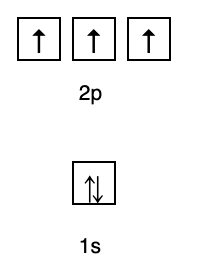
จากการจัดเรียงนั้น คุณจะเห็นว่าลำดับของระดับพลังงานคือ 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p เป็นต้น
2. กฎร้อย
กฎนี้ระบุว่าหากมีออร์บิทัลที่ระดับพลังงานเท่ากัน อิเล็กตรอนจะต้องเป็น ขนานกันจนออร์บิทัลทั้งหมดในระดับพลังงานเดียวกันเต็มไปด้วยอิเล็กตรอน ดังแสดงในรูปที่ กำลังติดตาม.
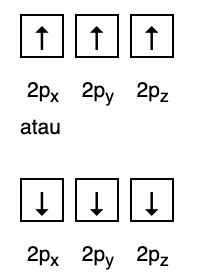
ในขณะเดียวกัน รูปต่อไปนี้ไม่สอดคล้องกับการเติมภายใต้กฎของ Hund
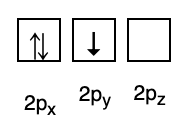
3. ข้อห้ามของเปาลี
ข้อห้าม Pauli ระบุว่าอิเล็กตรอนไม่สามารถมีเลขควอนตัมเดียวกันได้เมื่อเติมในวงโคจร ดังนั้นจึงมีเลขสปินที่มีค่า +1/2 พลังงานต่ำสุดคือพลังงานที่มีจำนวนอิเล็กตรอนคู่และสปินคู่ขนานมากที่สุด
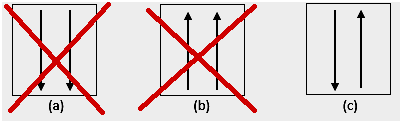
4. ความผิดปกติ

จากการทดลอง มีความผิดปกติในการกำหนดค่าอิเล็กตรอนตามกฎที่กล่าวถึงข้างต้น d subshell มักจะครึ่งเต็มหรือเต็ม ตัวอย่างเช่น สำหรับ 24Cr การกำหนดค่าอิเล็กตรอน: [Ar] 4s1 3d5 มีความเสถียรมากกว่า [Ar] 4s2 3d4
นอกจากนี้ การกำหนดค่าอิเล็กตรอนสำหรับ 29Cu: [Ar] 4s1 3d10, เสถียรกว่า [Ar] 4s2 3d9. ในขณะเดียวกัน การจัดโครงแบบอิเล็กตรอนสำหรับโมโนอะตอมมิกไอออน เช่น K+, นา+, Ca2+, บรา–, ส2-และอื่นๆ สามารถกำหนดได้โดยอะตอมที่เป็นกลางก่อน
สำหรับไอออนบวกหรือไอออนบวก monatomic Ax+ ด้วยประจุ x+ จากนั้นให้มากที่สุดเท่าที่ x อิเล็กตรอนจะถูกลบออกจากเปลือกอิเล็กตรอนชั้นนอกของอะตอมที่เป็นกลาง A สำหรับประจุลบ โมโนโทมิก Bย- ด้วยประจุ y มากเท่ากับอิเล็กตรอน y ถูกจับในวงโคจรพลังงานต่ำสุดที่ยังไม่เต็ม
วิธีการกำหนดตัวเลขควอนตัม
ก่อนกำหนดจำนวน คุณต้องกำหนดค่าอิเล็กตรอนขององค์ประกอบที่คุณต้องการหาค่าควอนตัมก่อน ตัวอย่างเช่น is 16เอส การกำหนดค่าอิเล็กตรอนของมันคือ 1s2 2s2 2p6 3s2 3p4. หลังจากนั้น ให้ใช้การกำหนดค่าอิเล็กตรอนตัวสุดท้าย ซึ่งก็คือ 3p4.
- ตามการกำหนดค่านี้ ค่าตัวเลขหลักคือ 3 เนื่องจากหมายเลข 3 หมายถึงขนาดของออร์บิทัลหรือเชลล์
- p เป็นเปลือกย่อยของอิเล็กตรอน จึงสามารถหาได้ภายใต้ค่า l = 1
- เนื่องจากมันอยู่ใน subshell p หมายเลขควอนตัมจะอยู่ระหว่าง -1, 0, หรือ +1 ในการพิจารณาให้วาดกล่องโคจรก่อน คุณสามารถใช้ลูกศรเมื่อกรอกกล่อง
- เติมลูกศรชี้ขึ้นในแต่ละช่อง แล้วเติมด้วยลูกศรชี้ลง เลข 4 คือจำนวนลูกธนูที่ต้องเติมจึงจะได้มาแบบนี้
↑↓ ↑ ↑
-1 0 +1
- ลูกศรที่สี่ (สุดท้าย) อยู่ในกล่อง -1 โดยที่ค่าเชิงกลคือ m = -1
- ลูกศรขึ้นมีค่า +1/2 ในขณะที่ลูกศรลงมีค่า -1/2 ลูกศรสุดท้ายคือลูกศรชี้ลง ดังนั้นค่าของ s = -1/2
นั่นคือวิธีการหาเลขควอนตัม ต่อไปนี้คือตัวอย่างคำถามที่เกี่ยวข้องกับเนื้อหานี้เพื่อให้คุณศึกษา
อ่าน: การเปลี่ยนแปลงทางกายภาพ
ตัวอย่างเลขควอนตัม

ตรวจสอบคำถามต่อไปนี้!
1. ตัวอย่างคำถาม 1
กำหนดโครงร่างของอิเล็กตรอนและไดอะแกรมอิเล็กตรอนขององค์ประกอบต่อไปนี้และไอออนของโมโนโมโน!
- 8อู๋2-
- 20มก2+
- 26เฟ3+
- 27โค
- 32เก
วิธีการแก้:
- การกำหนดค่าอิเล็กตรอน 8O2:1s2 2s2 2p4 หรือ [เขา] 2s2 2p4
การกำหนดค่าอิเล็กตรอน 8O2–: 1s2 2s2 2p6 หรือ [เขา] 2s2 2p6 หรือ [Ne] (บวก 2 อิเล็กตรอน: 2s2 2p4+2)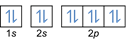
- การกำหนดค่าอิเล็กตรอน 20มก.: 1s2 2s2 2p6 3s2 3p6 4s2 หรือ [อร] 4s2
การกำหนดค่าอิเล็กตรอน 20มก2+: 1s2 2s2 2p6 3s2 3p6 หรือ [Ar] (ลบ 2 อิเล็กตรอนจากเปลือกนอก: 4s2-2)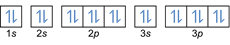
- การกำหนดค่าอิเล็กตรอน 26เฟ: 1s2 2s2 2p6 3s2 3p6 4s2 3d6 หรือ [อร] 4s2 3d6
การกำหนดค่าอิเล็กตรอน 26เฟ3+: 1s2 2s2 2p6 3s2 3p6 3d5 หรือ [Ar]3d5 (ลบ 3 อิเล็กตรอนจากเปลือกนอก: 4s2-2 3d6-1)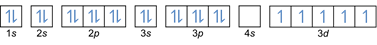
- การกำหนดค่าอิเล็กตรอน 27Co: 1s2 2s2 2p6 3s2 3p6 4s2 3d7 หรือ [อร] 4s2 3d7
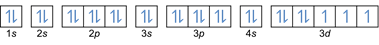
- การกำหนดค่าอิเล็กตรอน 32Ge: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p2 หรือ [อร] 4s2 3d10 4p2
2. ตัวอย่างคำถาม 2
อิเล็กตรอนตัวสุดท้ายใน Ga มีเลขควอนตัม...
- n = 4; ล. = 0
- n = 4; ล. = 1
- n = 3; ล. = 2
- n = 4; ล. = 2
- n = 3; ล. = 1
วิธีการแก้:
หากคุณดูตารางธาตุเคมีธาตุ Ga จะอยู่ในช่วงเวลา IV โดยให้ n = 4 แกลเลียมอยู่ในกลุ่มที่ 13 ดังนั้นวาเลนซ์อิเล็กตรอนจึงอยู่ในเปลือกย่อย p ซึ่งหมายถึง l = 1
3. ตัวอย่างคำถามที่ 3
ด้านล่าง หมายเลขควอนตัมที่อิเล็กตรอนตัวสุดท้ายของอะตอม Cl ไม่สามารถครอบครองได้คือ...
- n = 3; ล. = 1; ม. = -1; s = -1/2
- n = 3; ล. = 1; ม. = 0; ส =
- n = 3; ล. = 2; ม. = -1; ส =
- n = 3; ล. = 2; ม. = 1; s = -1/2
- n = 3; ล. = 1; ม. = 1; s = 1/2
วิธีการแก้:
เนื่องจากองค์ประกอบ Cl อยู่ในช่วง 3 ดังนั้น n = 3 Cl เป็นกลุ่ม 17 ด้วย ดังนั้นวาเลนซ์อิเล็กตรอนจึงอยู่ในเปลือกย่อย p ดังนั้น l = 1 ค่าของ m สามารถเป็น -1, 0, หรือ +1 ได้ เนื่องจากพลังงานของเลขควอนตัมทั้งสามมีค่าเท่ากัน และลำดับการเติมไม่สำคัญ
สำหรับ s สามารถมีค่าได้ -1/2 หรือ 1/2 ดังนั้นเราจึงไม่สามารถกำหนด m และ s ได้อย่างแน่ชัด
4. ตัวอย่างคำถาม 4
องค์ประกอบ X3+ มีอิเลคตรอนแบบเดียวกับธาตุ Ar ดังนั้น ไอออนที่มีโครงแบบเดียวกับไอออนคือ...
- K+
- มก2+
- นา+
- Cl+
- F–
วิธีการแก้:
องค์ประกอบ Ar อยู่ในช่วง 3 ดังนั้นไอออนที่มีการกำหนดค่าอิเล็กตรอนแบบเดียวกับ Ar หรือ [Ne] 3s2 3p6 จะอยู่ในคาบที่ 4 สำหรับไพเพอร์ และคาบที่ 3 สำหรับแอนไอออน ไอออนที่เหมาะสมที่สุดคือ K+.
5. ตัวอย่างคำถามที่ 5
กำหนดจำนวนควอนตัมขององค์ประกอบ 32เกะ!
วิธีการแก้:
การกำหนดค่าอิเล็กตรอน 32Ge: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p2 หรือ [อร] 4s2 3d10 4p2.
การกำหนดค่าสุดท้ายคือ 4p2. ระดับพลังงานคือ 4 และอยู่ในเปลือกย่อย p ดังนั้น n = 4 และ l = 1 4p. การวาดไดอะแกรมการโคจร2 เพื่อทราบตัวเลขอื่นๆ ดังนี้
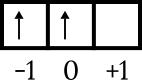
อิเล็กตรอนตัวสุดท้ายอยู่ในกล่องออร์บิทัล 0 ลูกศรชี้ขึ้น ดังนั้น m = 0 และ s = +1/2
6. ตัวอย่างคำถามที่ 6
อนุญาตเลขควอนตัมทั้งหมดต่อไปนี้ ยกเว้น...
- n = 2; ล. = 1; ม = -1
- n = 3; ล. = 2; ม. = 1
- n = 3; ล. = 3; ม = -1
- n = 3; ล. = 0; ม. = 0
- n = 3; ล. = 2; ม = -1
วิธีการแก้:
หากค่าของตัวเลขหลัก (n) คือ 3 ดังนั้นจำนวนแอซิมัทสูงสุด (l) คือ n-1 = 3-1 = 2 ดังนั้น จึงไม่อนุญาตตัวเลือก C ที่มี n = 3, l = 3 และ m = -1
ในการเรียนรู้เลขควอนตัม คุณต้องเข้าใจเลขอะตอมขององค์ประกอบที่มักใช้หรือปรากฏในปัญหาด้วย นอกจากนี้ คุณควรทำความคุ้นเคยกับการจัดระดับพลังงานเมื่อสร้างโครงแบบอิเล็กตรอน
X ปิด
โฆษณา
โฆษณา
X ปิด
