สูตรโมลาริตีและโมลาลิตีและปัญหาตัวอย่าง
กำลังโหลด...
ลักษณะคอลลิเกตของสารละลายเป็นหนึ่งในสารเคมีในกลุ่ม XI SMA เพื่อให้เข้าใจเนื้อหานี้ คุณต้องเชี่ยวชาญสูตรของโมลาริตีและโมลาลิตีของสารละลายให้ดี เพราะบทนี้มีความสัมพันธ์ใกล้ชิดกับความเข้มข้นของสารละลาย
สำหรับท่านที่ไม่ทราบ สารละลายเป็นส่วนผสมที่เป็นเนื้อเดียวกันของตัวทำละลาย (ปกติจะเป็นน้ำหรือ H2O) กับสารที่ละลาย เพื่อให้คุณเข้าใจเนื้อหานี้ได้ง่ายขึ้น เราขอนำเสนอตั้งแต่ความเข้าใจไปจนถึงตัวอย่างคำถามเกี่ยวกับโมลาริตีและโมลาลิตีของสารละลาย
รายการเนื้อหา
ทำความเข้าใจเกี่ยวกับโมลาริตี

โมลาริตีเป็นตัววัดความสามารถในการละลายซึ่งแสดงจำนวนโมลของตัวถูกละลายต่อปริมาตรของสารละลาย สัญลักษณ์ของโมลาริตีคือสัญกรณ์ M (ใหญ่) โดยมีหน่วยโมลาร์เท่ากับโมล/ลิตร
อ่าน: กรดเบส
สูตรโมลาริตี

ถ้าก่อนหน้านี้เป็นความเข้าใจโมลาริตี แล้วสูตรล่ะ? นี่คือสูตรโมลาริตี:
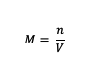
M = โมลาริตีของสาร (โมล หรือ โมล/ลิตร)
n = โมลของสาร (โมล)
V = ปริมาตรของสารละลาย (มล.)
นอกเหนือจากสูตรข้างต้น คุณยังสามารถคำนวณโมลาริตีโดยใช้สูตรต่อไปนี้:
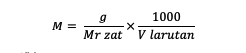
M = โมลาริตีของสาร (โมล หรือ โมล/ลิตร)
g = มวลของสาร (กรัม)
นาย = มวลโมเลกุลสัมพัทธ์ของสาร (กรัม/โมล)
V = ปริมาตรของสารละลาย (มล.)
หากผสมสารละลาย ให้ใช้สูตร:
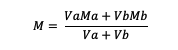
Va = ปริมาตรของสาร a
Vb = ปริมาตรของสาร b
Ma = โมลาริตีของสาร a
Mb = โมลาริตีของสาร b
หากสารละลายเจือจาง สูตรโมลาริตีที่ใช้จะเป็นดังนี้:
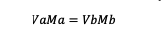
Va = ปริมาตรของสาร a
Vb = ปริมาตรของสาร b
Ma = โมลาริตีของสาร a
Mb = โมลาริตีของสาร b
เพื่อให้ได้ค่าโมล คุณต้องคำนวณโดยใช้สูตรด้านล่าง:
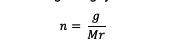
n = โมลของสาร (โมล)
g = มวลของสาร (กรัม)
นาย = โมเลกุลสัมพัทธ์ของสาร (กรัม/โมล)
คำจำกัดความของโมลาลิตี

คล้ายกันในแวบแรก แต่โมลาริตีต่างกัน คุณรู้ ด้วยศีลธรรม!
โมลาลหรือความเข้มข้นโมลาลคือจำนวนโมลของตัวถูกละลายต่อหนึ่งกิโลกรัมของตัวทำละลาย ตามคำจำกัดความ โมลาลิตีคือปริมาณที่ระบุจำนวนโมลของตัวถูกละลายต่อหน่วยน้ำหนักของตัวทำละลาย โมลาลิตีแสดงด้วยสัญกรณ์ ม. (เล็ก)
อ่าน: กฎของโอห์ม
สูตรโมลลิตี

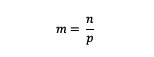
m = โมลาลิตีของสาร (โมลาลิตี)
n = โมลของสาร (โมล)
p = มวลของตัวทำละลาย (กรัม)
นอกจากนี้ คุณยังสามารถคำนวณโมลาลิตีโดยใช้สูตรต่อไปนี้:
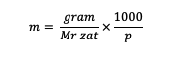
m = โมลาลิตีของสาร (โมลาลิตี)
นาย = โมเลกุลสัมพัทธ์ของสาร (กรัม/โมล)
p = มวลของตัวทำละลาย (กรัม)
ความแตกต่างระหว่างสูตรโมลาริตีและโมลาลิตี
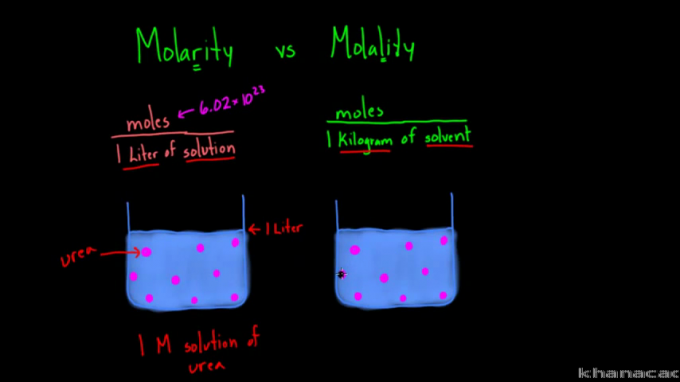
คำว่า 'โมลาริตี' และ 'โมลาลิตี' มักทำให้บางคนสับสนเนื่องจากการเขียนและการออกเสียงที่คล้ายคลึงกัน แม้ว่าทั้งสองจะใช้เพื่อวัดความเข้มข้นของสารละลาย แต่ก็มีความแตกต่างระหว่างทั้งสอง
จากสูตรข้างต้น จะเห็นได้ว่าความแตกต่างระหว่างโมลาริตีและโมลาลิตีอยู่ในแนวทาง ความเข้มข้นของโมลาริตีหรือโมลาร์จะวัดจำนวนโมลของสารต่อลิตรของสารละลาย ในขณะที่โมลาลิตีวัดจำนวนโมลของสารต่อกิโลกรัมของตัวทำละลาย
โฆษณา
อ่าน: สูตรธุรกิจ
ตัวอย่างปัญหากรามและการอภิปราย

ตอนนี้ หลังจากที่รู้สูตรโมลาริตีและโมลาลิตีแล้ว จะดีกว่าถ้าคุณพยายามแก้ปัญหาทันทีเพื่อให้เข้าใจเนื้อหาดีขึ้น มาเลย เพียงแค่ทำคำถามต่อไปนี้!
ปัญหาฟันกราม
1. ถ้าทราบว่ามวลของตัวถูกละลายคือ 11 กรัม ปริมาตรของสารละลายคือ 500 มล. และ Mr = 22 โมลาริตีคืออะไร?
ตอบ :
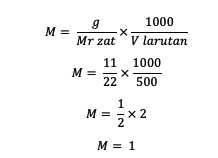
ดังนั้น โมลาริตีของสารคือ 1 โมล/ลิตร
2. 5 โมลาร์ HCl ที่มีปริมาตร 20 มล. ถูกเจือจางเป็น 0.4 โมลาร์ ดังนั้นควรเติมน้ำลงในสารละลายมากแค่ไหน?
ตอบ :
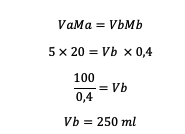
ดังนั้นปริมาณน้ำที่ต้องเติมคือ 250 มล.
3. กลูโคส (C6ชม12อู๋6) ซึ่งมีมวลสัมพัทธ์เท่ากับ 180 อยู่ในสารละลายน้ำตาลกลูโคส 0.1 โมลาร์ 500 มล. มวลของกลูโคสคืออะไร?
ตอบ :

ดังนั้น มวลที่ครอบครองโดยกลูโคส (C6ชม12อู๋6) คือ 9 กรัม
4. ปริมาตรของตัวทำละลายในสารละลาย H. คืออะไร?2ดังนั้น4 0.2 M ซึ่งตัวละลายคือ 0.3 โมล?
ตอบ :
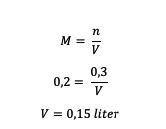
ดังนั้น ปริมาตรของตัวทำละลายคือ 0.15 ลิตร
5. กลูโคสทั้งหมด 18 กรัม (C6ชม12อู๋6) โดย Mr = 180 ละลายในน้ำเพื่อให้ปริมาตรกลายเป็น 0.5 L. โมลาริตีของสารละลายคืออะไร?
ตอบ :

ก่อนอื่นให้คำนวณจำนวนโมลก่อน
ถัดไป คำนวณค่าโมลาริตี
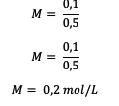
ดังนั้น โมลาริตีของสารละลายกลูโคสคือ 0.2 โมลต่อลิตร
6. ในการทำ 100 มล. ของสารละลาย 01, M NaOH ต้องละลาย NaOH (Mr = 40) กี่กรัม?
ตอบ :

ดังนั้นต้องใช้มวล NaOH ที่ต้องการ 0.4 กรัม
ปัญหาโมลาลิตี
1. เป็นที่ทราบกันดีอยู่แล้วว่าสารละลายมีมวล 11 กรัมของตัวทำละลาย ตัวทำละลาย 200 กรัม และ Mr = 22 แล้วคุณธรรมคืออะไร?
ตอบ :
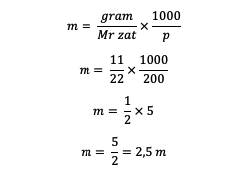
ดังนั้นจึงได้ค่าโมลาลิตี 2.5 ม.
2. เติมน้ำ 250 กรัมลงในสารละลายน้ำตาลอ้อย 17.1 กรัมซึ่งมี Mr = 342 molality ของสารละลายคืออะไร?
ตอบ :

ดังนั้น โมลาลิตีของสารละลายคือ 0.2 ม.
3. โมลาลิตีของสารละลาย NaOH 4 กรัม (ถ้าทราบว่า Ar Na = 23, O = 16, H = 1) ละลายในน้ำ 250 กรัม เป็นเท่าใด
ตอบ :
ก่อนคำนวณโมลาลิตี เราต้องคำนวณมวลสัมพัทธ์ก่อน
นาย = 23 + 16 + 1 = 40 กรัม/โมล
หลังจากนั้นมาคำนวณโมลาลิตีกัน
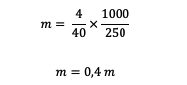
ดังนั้น โมลาลิตีที่มีอยู่ในสารละลาย NaOH คือ 0.4 ม.
4. molality ของสารละลาย HCl 37% เป็นเท่าใดหากทราบว่า Ar H = 1 และ Ar Cl = 35.5
ตอบ :
นาย = 1 + 35.5 = 36.5 กรัม/โมล
มวลของ HCl = 37% x 100 กรัม = 37 กรัม
มวลของตัวทำละลาย = มวลของสารละลาย – มวลของ HCl
มวลตัวทำละลาย = 100 – 37 กรัม
มวลตัวทำละลาย = 63 กรัม หรือ 0.063 กิโลกรัม
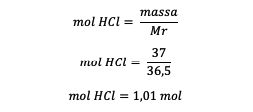
หลังจากทราบโมลของ HCl แล้ว ให้คำนวณโมลาลิตี
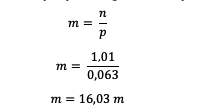
ดังนั้นจะเห็นได้ว่าโมลาลิตีของ HCl เท่ากับ 16.03 โมลาล
5. molality ของ 15 กรัมของ urea CO(NH .?2)2 ละลายในน้ำ 250 กรัม? (นาย = 60)
ตอบ :
คำนวณโมลของยูเรียก่อน
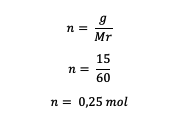
ต่อไป คำนวณโมลาลิตีของสารละลาย
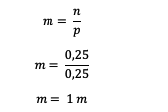
ดังนั้น โมลาลิตีของสารละลายยูเรียคือ 1 ม.
นั่นคือสูตรสำหรับโมลาริตีและโมลาลิตี พร้อมด้วยคำจำกัดความและตัวอย่างของปัญหา ง่ายใช่มั้ย? หวังว่าบทความนี้จะช่วยให้คุณเข้าใจได้ดีขึ้น ใช่. วิญญาณ!
X ปิด
โฆษณา
โฆษณา
X ปิด
