วาเลนซ์อิเล็กตรอน: ความหมาย วิธีการคำนวณ ตัวอย่างปัญหา
กำลังโหลด...
วาเลนซ์อิเล็กตรอนเป็นอิเล็กตรอนในระดับนอกสุดของอะตอมที่สามารถมีส่วนร่วมในการโต้ตอบกับอะตอมอื่นได้ ค่าความจุสามารถแสดงอะตอมเพื่อให้สามารถเห็นค่าปฏิสัมพันธ์ได้
จำนวนของเวเลนซ์ในอะตอมสามารถทำให้องค์ประกอบมีปฏิกิริยาหรือไม่ทำงาน ด้วยเหตุนี้ จึงเป็นสิ่งสำคัญมากที่จะต้องทราบจำนวนเวเลนซ์เพื่อให้สามารถทราบกิจกรรมขององค์ประกอบที่เกี่ยวข้องได้
รายการเนื้อหา
การทำความเข้าใจวาเลนซ์อิเล็กตรอน
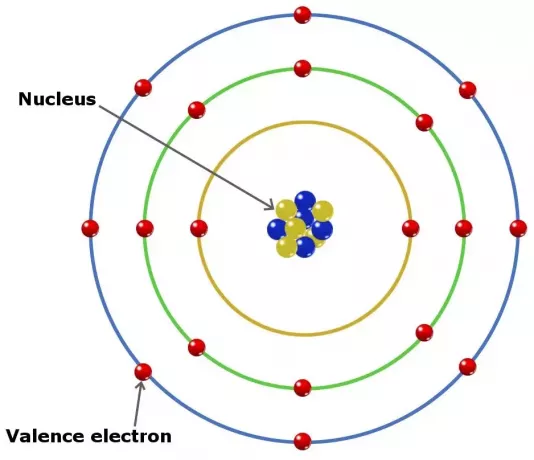
วาเลนซ์อิเล็กตรอนในอะตอมสามารถมีบทบาทในการสร้างพันธะเคมีในองค์ประกอบ ในองค์ประกอบในกลุ่มหลัก วาเลนซ์อิเล็กตรอนคืออิเล็กตรอนในเปลือกนอกสุด
ถึงกระนั้นก็ไม่ใช่ว่าอิเล็กตรอนทั้งหมดเหล่านี้จะอยู่ในเปลือกนอก ในองค์ประกอบบางอย่างที่เป็นของกลุ่มทรานซิชัน เวเลนซ์จะลึกกว่าเปลือกนอก
อ่าน: การกำหนดค่าอิเล็กตรอน
ตารางวาเลนซ์อิเล็กตรอน
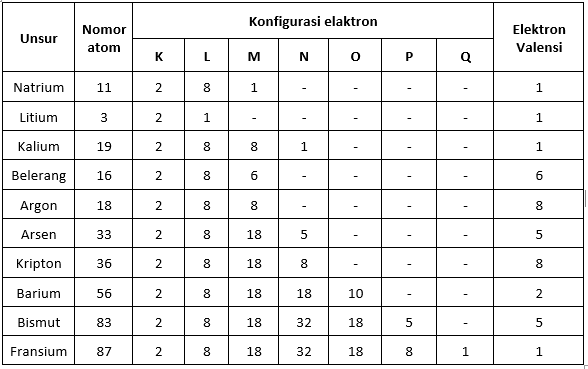
วาเลนซ์อิเล็กตรอนและระบบธาตุของธาตุ
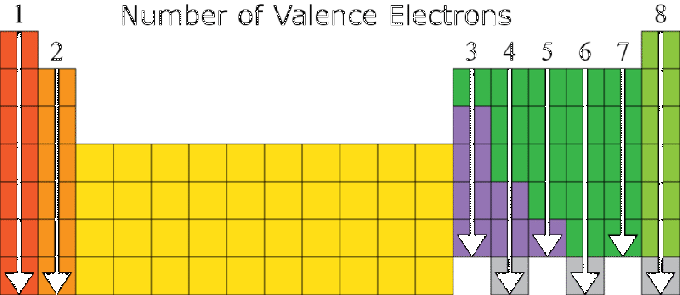
คุณสมบัติของธาตุขึ้นอยู่กับโครงสร้างอิเล็กตรอนของธาตุนั้นสูง โดยเฉพาะอย่างยิ่งกับเลขเวเลนซ์ของธาตุ องค์ประกอบที่มีจำนวนเวเลนซ์เท่ากันโดยทั่วไปจะมีคุณสมบัติคล้ายคลึงกัน ด้วยเหตุนี้ ระบบธาตุเป็นระยะจึงถูกจัดเรียงตามการเพิ่มขึ้นของเลขอะตอมและความคล้ายคลึงกันในคุณสมบัติของสาร
มีความสัมพันธ์ระหว่างการจัดเรียงอิเล็กตรอนของอะตอมของธาตุกับตำแหน่งของธาตุในระบบธาตุ โดยที่:
- หมายเลขกลุ่มจะเหมือนกับจำนวนค่าเวเลนซ์ ยกเว้นองค์ประกอบ He ในกลุ่ม VIIIA และกลุ่มทรานซิชัน
- เลขคาบเท่ากับจำนวนเปลือกบนอิเล็กตรอน
การนำไฟฟ้า
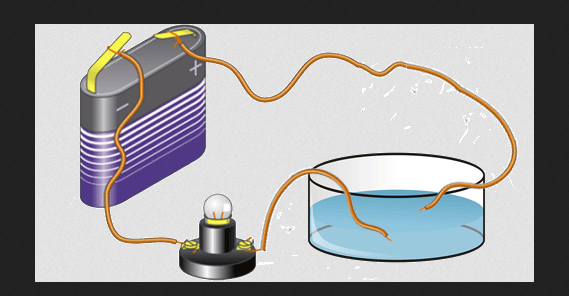
เวเลนซ์อิเล็กตรอนมีหน้าที่ในการนำไฟฟ้าของธาตุด้วย นี่คือสิ่งที่ทำให้องค์ประกอบต่างๆ สามารถจัดกลุ่มเป็นอโลหะ เซมิคอนดักเตอร์ และโลหะได้ องค์ประกอบที่เป็นโลหะโดยทั่วไปมีค่าการนำไฟฟ้าสูงเมื่ออยู่ในสถานะของแข็ง
ในแต่ละแถวของตารางธาตุ โลหะจะอยู่ทางด้านซ้ายของอโลหะ ดังนั้นโลหะจึงมีความจุน้อยกว่าโลหะที่ไม่ใช่โลหะ
อย่างไรก็ตาม ค่าเวเลนซ์ของอะตอมของโลหะมีพลังงานไอออไนซ์เล็กน้อย และในสถานะของแข็ง อิเล็กตรอนเหล่านี้ค่อนข้างอิสระที่จะปล่อย 1 อะตอมหรือรวมเข้ากับอะตอมอื่นๆ
อิเล็กตรอนอิสระแบบนี้สามารถเคลื่อนที่ได้โดยอิทธิพลของสนามไฟฟ้า การเคลื่อนที่ของอิเล็กตรอนสามารถบรรจุกระแสไฟฟ้าได้ อิเล็กตรอนเหล่านี้มีหน้าที่ในการนำไฟฟ้าของโลหะ ตัวอย่างของตัวนำไฟฟ้าที่ดี ได้แก่ อะลูมิเนียม ทองแดง ทอง และเงิน
องค์ประกอบที่ไม่ใช่โลหะมีค่าการนำไฟฟ้าต่ำจึงทำหน้าที่เป็นฉนวน องค์ประกอบเช่นนี้สามารถเห็นได้ในตารางธาตุทางด้านขวาและมีวาเลนซ์เชลล์อย่างน้อยครึ่งหนึ่ง
พลังงานไอออไนเซชันจะมีขนาดใหญ่หากอิเล็กตรอนไม่สามารถออกจากอะตอมได้อย่างง่ายดายเมื่อต้องเผชิญกับสนามไฟฟ้า ดังนั้นธาตุชนิดนี้จึงมีความสามารถในการนำกระแสน้ำขนาดเล็กมาก
ตัวอย่างขององค์ประกอบฉนวน ได้แก่ กำมะถันและเพชร สารประกอบที่เป็นของแข็งที่มีโลหะสามารถกล่าวได้ว่าเป็นฉนวนหากใช้เวเลนซ์ของอะตอมโลหะเพื่อสร้างพันธะไอออนิก
อ่าน: กลศาสตร์ควอนตัม
การกำหนดค่าอิเล็กตรอน
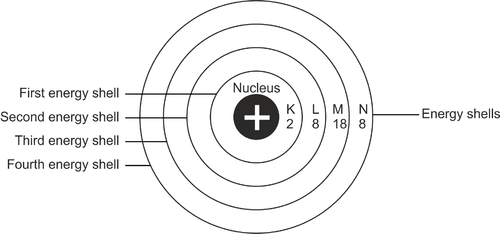
กระบวนการกำหนดค่าสามารถกล่าวได้ว่าเป็นการจัดเรียงของการกระจายอิเล็กตรอนในอะตอม โดยทั่วไป อิเล็กตรอนจะอยู่ในเส้นทางที่แน่นอนของอะตอม ถูกกำหนดตามระดับพลังงานของอะตอม เส้นทางเหล่านี้เป็นเปลือกอิเล็กตรอน
ส่วนแรกของชั้นผิวหนังแสดงด้วยตัวอักษร K ชั้นผิวหนังจะยังคงเป็น L, M และอื่นๆ ตามลำดับตัวอักษร เปลือก K อยู่ใกล้กับนิวเคลียสของอะตอมมากที่สุด เปลือกแต่ละชั้นสามารถรองรับอิเล็กตรอนได้จำนวนหนึ่งเท่านั้น
โฆษณา
ดังนั้นถ้ามันเต็ม อิเล็กตรอนจะเคลื่อนไปยังชั้นถัดไป จำเป็นต้องเติมผิวทุกชั้นให้เต็มประสิทธิภาพสูงสุด
วิธีการนับวาเลนซ์อิเล็กตรอน

ตำแหน่งของอิเล็กตรอนเมื่อเริ่มเติมอะตอมเริ่มจากชั้นแรกของเปลือก ชั้นผิวหนังนี้อยู่ใกล้กับนิวเคลียสของอะตอมมากที่สุดหรือเขียนแทนด้วยตัวอักษร K ชั้นแรกมีระดับพลังงานต่ำสุด ถ้าชั้นแรกเต็มไปด้วยอิเล็กตรอน 2 ตัว ก็จะต่อด้วยการเติมชั้นถัดไปที่เรียกว่า L
เปลือก L มีความจุ 8 อิเล็กตรอน หากอิ่มก็จะค่อยๆ เข้าสู่ผิวชั้นถัดไป ความจุรวมของเปลือกนอกสุดของอะตอมคือ 8 อิเล็กตรอน
องค์ประกอบที่เป็นของกลุ่มหลัก การกำหนดค่าอิเล็กตรอนสามารถกำหนดได้ตามจำนวนอิเล็กตรอนหรือเลขอะตอมตามกฎต่อไปนี้
- อิเล็กตรอนจะถูกชาร์จจนเต็มจนถึงขีดจำกัดสูงสุดที่ชั้นผิวหนังสามารถรองรับได้
- หากยังมีอิเล็กตรอนเหลืออยู่หรือไม่สามารถเติมชั้นเปลือกอิเล็กตรอนได้เต็มที่ ให้ใส่ใจกับข้อกำหนดต่อไปนี้
- หากจำนวนอิเล็กตรอนที่เหลืออยู่ > 32 แสดงว่าส่วนต่อไปของเปลือกหุ้มด้วยอิเล็กตรอน 32 ตัว
- ถ้าอิเล็กตรอนเหลือ < 32 ชั้นเปลือกถัดไปจะรองรับ 18 อิเล็กตรอน;
- หากอิเล็กตรอนเหลือ < 18 ชั้นถัดไปจะเต็มไปด้วยอิเล็กตรอน 8 ตัว
- หากจำนวนที่เหลือคือ 8 อิเล็กตรอนที่เหลือสามารถเติมส่วนถัดไปของเปลือกได้
อ่าน: การเปลี่ยนแปลงทางกายภาพ
ตัวอย่างของปัญหาวาเลนซ์อิเล็กตรอน

เพื่อให้เข้าใจเนื้อหาอย่างลึกซึ้งยิ่งขึ้น โปรดดูตัวอย่างและการสนทนาต่อไปนี้
ตัวอย่างที่ 1
กำหนดค่าเวเลนซ์ขององค์ประกอบต่อไปนี้ตามการกำหนดค่าอิเล็กตรอน
- 11นา
- 13อัล
- 15พี
- 18อา
- 19K
ตอบ:
- 11นา = 2 8 1
จำนวนความจุของ Na = 1
- 13อัล = 2 8 3
จำนวนความจุ Al = 3
- 15P = 2 8 5
ความจุรวม P = 5
- 18อาร์ = 2 8 8
จำนวนความจุ Ar = 8
- 19K = 2 8 8 1
จำนวนความจุ K = 1
ตัวอย่าง 2
สร้างการกำหนดค่าอิเล็กตรอนและกำหนดค่าความจุขององค์ประกอบต่อไปนี้โดยใช้การกำหนดค่าอิเล็กตรอนก๊าซมีตระกูล
- 20Ca
- 35br
- 36Cr
- 50Sn
- 86Rn
ตอบ:
- 20Ca = [Ar] 4s2
ผลรวมของค่าความจุของ Ca = 2
- 35Br = [Ar] 3d10 4s2 4p5
ผลรวมของค่าความจุของ Br = 7
- 36Kr = [Ar] 3d10 4s2 4p6
ผลรวมของค่าความจุ Kr = 8
- 50Sn = [Kr] 4d10 5s2 5p2
ผลรวมของค่าความจุของ Sn = 4
- 86Rn = [Xe] 4f14 5 วัน10 6s2 6p6
ผลรวมของค่าความจุ Rn = 8
ตัวอย่างที่ 3
โปรดเขียนอิเล็กตรอนของธาตุด้านล่างและกำหนดค่าเวเลนซ์ด้วย
- 10 เน่
- 33 เรา
- 47 Ag
- 52 เต
- 54 เซ
ตอบ:
- 10 Ne: 1s2 2s2 2p6
ผลรวมของค่าความจุของ Ne = 8
- 33 เอซ: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p3
ผลรวมของค่าความจุของ As = 5
- 47 Ag: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4 วัน10
ผลรวมของค่าความจุของ Ag = 1
- 52 เท: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4 วัน10 5p4
ผลรวมของค่าความจุของ Te = 6
- 54 Xe: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4 วัน10 5p6
ผลรวมของค่าความจุของ Xe = 8
วาเลนซ์อิเล็กตรอนสามารถกำหนดได้ตามเส้นทางหรือวงโคจรที่ระบุโดยใช้การกำหนดค่าอิเล็กตรอน แม้ว่าจะดูค่อนข้างซับซ้อน แต่การเรียนรู้เนื้อหานี้เป็นสิ่งที่ต้องทำเพื่อให้สามารถทำงานกับคำถามได้อย่างง่ายดาย
X ปิด
โฆษณา
โฆษณา
X ปิด
