การกำหนดค่าอิเล็กตรอน: ความหมาย ตาราง ตัวอย่าง
กำลังโหลด...
ทุกคนรู้ดีว่าอะตอมเป็นสิ่งที่เล็กที่สุดที่ไม่สามารถแบ่งแยกทางเคมีได้อีกต่อไป แต่สสารที่เล็กที่สุดประกอบด้วยอนุภาคหลายตัว รวมถึงอิเล็กตรอนด้วย การกำหนดค่าอิเล็กตรอนมีบทบาทสำคัญในระบบอะตอม
อิเล็กตรอนเป็นอนุภาคที่ประกอบเป็นอะตอมซึ่งมีประจุเป็นลบ เมื่อรวมกับโปรตอนที่มีประจุบวกและนิวตรอนเป็นกลาง ทั้งสามนี้ประกอบขึ้นเป็นส่วนประกอบของอะตอม อิเล็กตรอนอยู่ในเปลือกนอกของอะตอม ในขณะที่โปรตอนและนิวตรอนอยู่ในนิวเคลียสของอะตอม
รายการเนื้อหา
การกำหนดค่าอิเล็กตรอนคืออะไร?
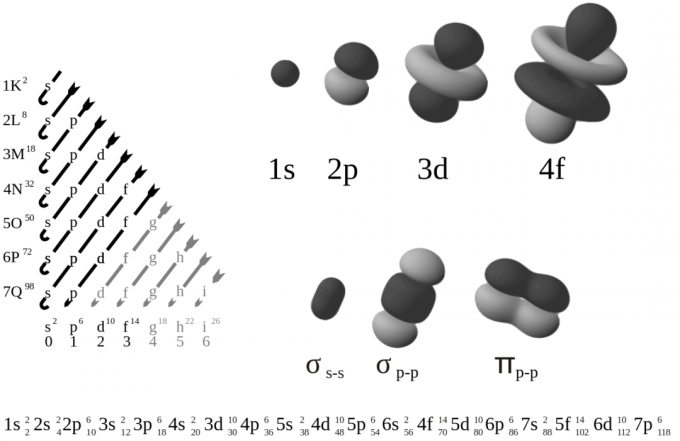
การมีอยู่ของอิเล็กตรอนในวงโคจรของอะตอมหรือเปลือกหุ้มนั้นไม่สามารถคาดเดาได้ เว้นแต่จะมีการดำเนินการวัดเพื่ออำนวยความสะดวกในการตรวจจับตำแหน่งของอิเล็กตรอน อิเล็กตรอนเคลื่อนที่ไปรอบ ๆ นิวเคลียสของอะตอมและคงอยู่ในวงโคจรที่แน่นอน อันที่จริงวงโคจรเป็นอีกคำหนึ่งสำหรับเปลือกอะตอม
เปลือกและเปลือกย่อยของอะตอมมีระดับพลังงานต่างกัน การกำหนดค่าอิเล็กตรอนหมายถึงการจัดเรียงอิเล็กตรอนในโมเลกุล อะตอม หรือโครงสร้างทางกายภาพประเภทอื่นๆ สถานะควอนตัมของอิเล็กตรอนขึ้นอยู่กับฟังก์ชันคลื่น
ฟังก์ชันคลื่นคือฟังก์ชันของพื้นที่และเวลาที่มีค่าเชิงซ้อน อิเล็กตรอนสามารถเคลื่อนที่จากระดับพลังงานหนึ่งไปอีกระดับหนึ่งได้โดยการดูดกลืนควอนตัมในรูปของโฟตอน ในการจัดเรียงอิเล็กตรอนจะมีชั้นของวงโคจรที่มีคุณสมบัติต่างกัน
อ่าน: การเปลี่ยนแปลงทางฟิสิกส์
1. ประเภทผิวอิเล็กตรอน
เปลือกอิเล็กตรอนแบ่งออกเป็นหลายชั้นซึ่งมีระยะห่างต่างกัน เปลือกในชั้นแรกที่ใกล้กับศูนย์กลางหรือนิวเคลียสของอะตอมมากที่สุดคือเปลือก K ชั้นที่สองหลังจากเปลือก K เรียกว่าเปลือก L เปลือก M แสดงถึงชั้นผิวหนังที่สาม เป็นต้น
ลำดับตัวอักษรที่แสดงประเภทของเปลือกอิเล็กตรอนแสดงว่าเปลือกเคลื่อนออกจากนิวเคลียสของอะตอม เพื่อให้เข้าใจง่ายขึ้น เลขควอนตัมหลัก (n) สามารถแทนเปลือกอิเล็กตรอนได้
กล่าวอีกนัยหนึ่ง เลขควอนตัมคือตัวเลขที่อธิบายตำแหน่งของอิเล็กตรอนในอะตอม ตัวเลขนี้บ่งบอกถึงธรรมชาติของอิเล็กตรอนในออร์บิทัลและแสดงถึงปริมาณที่อนุรักษ์ไว้ในระบบไดนามิก
ตัวเลขควอนตัมที่แสดงเปลือกอะตอมขึ้นต้นด้วยเลข 1 ซึ่งหมายความว่าหมายเลข 1 หมายถึงเปลือก K หมายเลข 2 หมายถึงเปลือก L หมายเลข 3 หมายถึงเปลือก M และอื่นๆ
2. ระดับพลังงานในเปลือกอิเล็กตรอน
ตำแหน่งของอิเล็กตรอนในวงโคจรหรือเปลือกของอิเล็กตรอนจะแสดงปริมาณพลังงานที่แตกต่างกัน ดังนั้นตำแหน่งของเปลือกอิเล็กตรอนจึงสัมพันธ์กับระดับพลังงานของอิเล็กตรอนในวงโคจรของเปลือกอย่างใกล้ชิด กล่าวโดยสรุป ระยะห่างของเปลือกอิเล็กตรอนจากศูนย์กลางของอะตอมเป็นตัวกำหนดพลังงานของอิเล็กตรอน
ยิ่งจำนวน n มากเท่าใด ระยะห่างของเปลือกอิเล็กตรอนจากศูนย์กลางของอะตอมก็จะยิ่งไกลขึ้นเท่านั้น และพลังงานของอิเล็กตรอนในเปลือกที่สอดคล้องกันก็จะยิ่งมากขึ้นเท่านั้น โดยปกติอิเล็กตรอนจะเติมออร์บิทัลของอะตอมในเปลือก K ก่อนซึ่งมีระดับพลังงานต่ำที่สุด
3. จำนวนอิเล็กตรอนในแต่ละเชลล์
โดยทั่วไป จำนวนอิเล็กตรอนที่เติมเปลือกอิเล็กตรอนมีขีดจำกัดที่แน่นอน จำนวนอิเล็กตรอนสูงสุดในเปลือกนอกสุดของอะตอมคือ 8 ในการกำหนดจำนวนอิเล็กตรอนที่อาศัยอยู่ในเปลือกบาง ๆ สามารถใช้สูตรต่อไปนี้:
เปลือกอิเล็กตรอนที่ n = 2n²
อ่าน: โมเมนต์ความเฉื่อย
ตารางการกำหนดค่าอิเล็กตรอน
การจัดเรียงอิเล็กตรอนในองค์ประกอบถูกเขียนขึ้นตามกฎที่นักวิทยาศาสตร์เห็นด้วย แนวคิดเกี่ยวกับโครงร่างหรือการจัดเรียงอิเล็กตรอนของอะตอมมีความสำคัญอย่างยิ่งในการทำความเข้าใจโครงสร้างในตารางธาตุ ตารางการกำหนดค่าหรือการจัดเรียงอิเล็กตรอนและองค์ประกอบของอิเล็กตรอนมีดังต่อไปนี้

ตัวอย่างปัญหาการกำหนดค่าอิเล็กตรอน
วิชาเคมีมักถามคำถามเกี่ยวกับการจัดเรียงอิเล็กตรอน เป็นความคิดที่ดีที่จะฝึกฝนการตอบคำถามเกี่ยวกับโครงร่างหรือการจัดเรียงอิเล็กตรอนดังต่อไปนี้
การกำหนดค่าและจำนวนของอิเล็กตรอนในแต่ละเปลือกอิเล็กตรอนในอะตอมของธาตุ Sr (Z=38) และ Ni (Z=28) คืออะไร?
ตอบ:
ซีเนียร์(Z = 38)
1s²; 2s²; 2p⁶ ;
3s²; 3p⁶ ;
4s² ;3d¹⁰; 4p⁶; 5วินาที²
หรือ [Kr] 5s²
K = 2
L = 8
M = 18
โฆษณา
ยังไม่มีข้อความ = 8
O = 2
Ni(Z = 28)
1s²; 2s² ;
2p⁶; 3s²; 3p⁶ ;
4s²; 3d⁸
หรือ [Ar] 4s² 3d⁸
K = 2
L = 8
M = 16
ยังไม่มีข้อความ = 2
อ่าน: กลศาสตร์ควอนตัม
กฎเต็ม / ครึ่งเต็ม

การโคจรของอิเล็กตรอนหรือเปลือกย่อยแต่ละอันมีข้อ จำกัด ของตัวเองสำหรับอิเล็กตรอนที่ครอบครอง สิ่งนี้สามารถช่วยเกี่ยวกับกฎเต็มและครึ่งเต็ม โดยทั่วไปแล้ว subshells มี 4 ประเภท ได้แก่ s, d, f และ p โดยที่ subshell แต่ละอันมีจำนวนอิเล็กตรอนต่างกัน
1. s subshell
s ออร์บิทัลสามารถรองรับอิเล็กตรอนได้สูงสุด 2 ตัว
2. หน้า. เปลือกย่อย
จำนวนอิเล็กตรอนสูงสุดในเปลือกย่อย p คือ 6
3. d เปลือกย่อย
จำนวนอิเล็กตรอนสูงสุดในเปลือกย่อย d คือ 10
4. ฉ. เปลือกย่อย
เปลือกย่อย f สามารถเก็บอิเลคตรอนได้สูงสุด 14 อิเล็กตรอน
การเขียนออร์บิทัลและจำนวนอิเล็กตรอนในนั้นคือการรวมเลขเปลือกก่อน ตามด้วยออร์บิทัล และสุดท้ายคือจำนวนอิเล็กตรอน
ตัวอย่างเช่น:
1s² ;2s² ;2p⁶ ;
3s² ;3p⁶ ;
4s² ;3d¹⁰ ;4p⁶
ฯลฯ
ดังนั้น กฎทั้งหมดหรือบางส่วนในการจัดเรียงอิเล็กตรอนแสดงให้เห็นว่าอิเล็กตรอนสามารถเคลื่อนที่จากวงโคจรหนึ่งไปยังอีกวงโคจรหนึ่งเพื่อให้ได้การจัดเรียงที่เสถียรมากขึ้น กฎนี้ใช้กับการกำหนดค่าที่ลงท้ายด้วย subshell d
อ่าน: พลังงานศักย์
แผนภาพการโคจร
ตำแหน่งของอิเล็กตรอนในชั้นเปลือกสองสามชั้นแรกจนถึงอะตอมที่ไกลที่สุดเป็นไปตามกลศาสตร์ควอนตัม คำว่าออร์บิทัลไดอะแกรมหมายถึงคำอธิบายของอิเล็กตรอนในออร์บิทัลของอะตอม
ในแผนภาพนี้ ลูกศรขึ้นหรือลงแสดงถึงอิเล็กตรอน ในขณะที่วงโคจรซึ่งอิเล็กตรอนอยู่ในรูปของกล่อง s ออร์บิทัลมี 1 สี่เหลี่ยม d มี 5 สี่เหลี่ยม p มี 3 สี่เหลี่ยม และ f มี 7 สี่เหลี่ยม
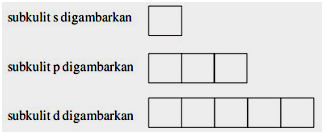
เมื่อสร้างไดอะแกรมการโคจร จำเป็นต้องให้ความสนใจกับกฎซึ่งรวมถึงกฎของ Hund และหลักการยกเว้นของ Pauli คำอธิบายเพิ่มเติมของกฎเหล่านี้อยู่ด้านล่าง
อ่าน: มิติพลังงาน
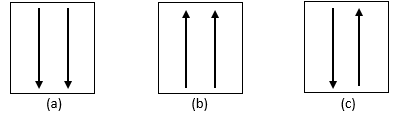
หลักการห้ามของ Paulis
ตามหลักการกีดกันของ Pauli มีอิเล็กตรอนไม่เกินสองตัวในวงโคจรของอะตอม ดังนั้นอิเล็กตรอนสามารถเคลื่อนที่จากวงโคจรหนึ่งไปยังอีกวงหนึ่งได้ก็ต่อเมื่อประกอบด้วย ความว่างเปล่า ตัวอย่างเช่น อะตอมที่มีอิเล็กตรอนสองตัวในวงโคจร 1s จะแสดงในรูปด้านล่าง:
กฎร้อย
กฎของฮันด์ระบุว่าออร์บิทัลที่มีพลังงานเท่ากันจะถูกเติมด้วยอิเล็กตรอนหนึ่งตัวที่มีพลังงานเท่ากันก่อน มีทิศทางหรือสปินเหมือนกัน แล้วอิเล็กตรอนจะเข้าสู่ออร์บิทัลตามลำดับ ตรงข้าม.
นั่นคือในเปลือกย่อยเดียวกันแต่ละออร์บิทัลมีอิเล็กตรอนหนึ่งตัวที่มีลูกศรเหมือนกันในทิศทางจากนั้นอิเล็กตรอนที่เหลือจะถูกเติมด้วยอิเล็กตรอนคู่หนึ่งในทิศทางตรงกันข้ามกับลูกศร คำอธิบายเพิ่มเติมอยู่ในภาพต่อไปนี้

อิเล็กตรอนอยู่ในการจัดเรียงบางอย่างในอะตอม คำที่อธิบายการจัดเรียงนี้คือการกำหนดค่าอิเล็กตรอน ด้วยการทำความเข้าใจตารางการกำหนดค่า แผนภาพการโคจร และกฎอื่นๆ คำถามเกี่ยวกับการกำหนดค่าหรือการจัดเรียงอิเล็กตรอนสามารถตอบได้ง่าย
X ปิด
โฆษณา
โฆษณา
X ปิด
