พันธะไอออนิก: คำจำกัดความ กระบวนการขึ้นรูป ความเป็นเอกลักษณ์ ตัวอย่าง
พันธะเคมีเป็นพันธะที่สามารถเกิดขึ้นได้เนื่องจากการมีอยู่ขององค์ประกอบต่าง ๆ ในสภาวะที่ไม่เสถียร แต่พยายามที่จะเสถียรเหมือนก๊าซ พันธะอันสูงส่งโดยสร้างพันธะกับธาตุอื่น ๆ และพิจารณาจากชนิดของพันธะ พันธะเคมี แบ่งออกเป็น 2 พันธะ คือ พันธะโควาเลนต์ และพันธะเคมี ไอออน.
สารบัญ
คำจำกัดความของพันธะไอออนิก
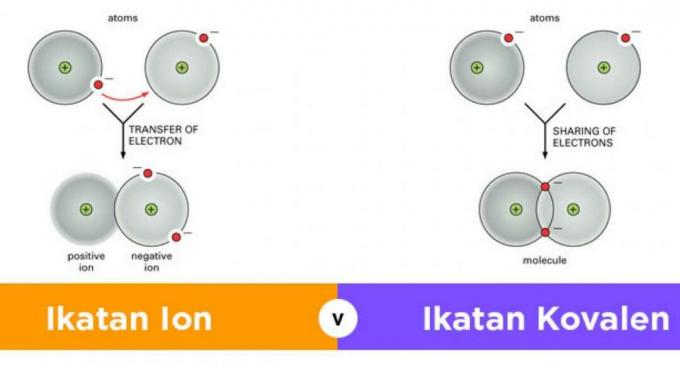
พันธะไอออนิกหรือพันธะไอออนิกเป็นพันธะที่อาจเกิดขึ้นจากการถ่ายโอนอิเล็กตรอนจากอะตอมหนึ่งไปยังอีกอะตอมหนึ่ง
มีเงื่อนไขหลายประการในการสร้างพันธะไอออนิก ได้แก่:
- การถ่ายโอนอิเล็กตรอนจากองค์ประกอบอิเล็กโตรโพซิทีฟไปยังองค์ประกอบอิเล็กโตรเนกาทีฟ
- สร้างขึ้นระหว่างธาตุที่เป็นอิเล็กโตรโพซิทีฟ (โลหะ) กับธาตุที่เป็นอิเล็กโตรเนกาทีฟ (อโลหะ)
- ธาตุอิเล็กโตรโพซิทีฟจะสูญเสียอิเล็กตรอนเพื่อสร้างไอออนบวก ในขณะที่ธาตุอิเล็กโตรเนกาทีฟจะได้รับอิเล็กตรอนเพื่อสร้างแอนไอออน
ไม่เพียงเท่านั้น พันธะไอออนิกนี้ยังสามารถเกิดขึ้นได้เนื่องจากการส่งอิเล็กตรอน ทำให้เกิดไอออนบวกและไอออนลบ ซึ่งมีการกำหนดค่าอิเล็กตรอนเหมือนกับของก๊าซมีตระกูล
ไอออนบวกและไอออนลบถูกยึดเข้าด้วยกันโดยแรงไฟฟ้าสถิต สารประกอบที่ได้จะเรียกว่าสารประกอบไอออนิก
กระบวนการสร้างพันธะไอออนิก
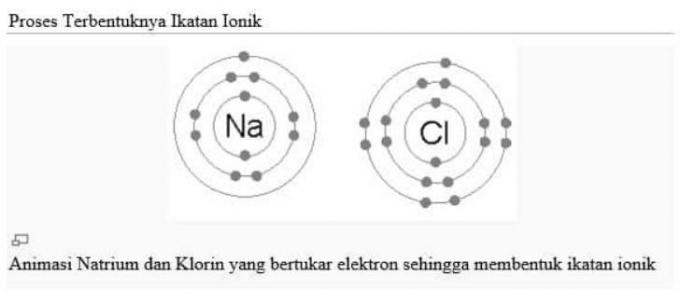
แต่ละองค์ประกอบต้องพยายามให้มีการกำหนดค่าอิเล็กตรอนเหมือนก๊าซมีตระกูลไม่ว่าจะโดยให้อิเล็กตรอนหรือยอมรับว่าอิเล็กตรอนมีความเสถียร
เหตุการณ์การส่งอิเล็กตรอนหนึ่งครั้งนี้สามารถเกิดขึ้นได้ด้วยสารประกอบ NaCl หรือที่เรียกว่าเกลือแกง
คำอธิบาย:
Na เป็นกลุ่ม IA โดยที่ IA มีเวเลนซ์อิเล็กตรอน 1 ตัว ดังนั้นเพื่อให้เสถียร IA จะต้องสูญเสียอิเล็กตรอนได้ 1 ตัว
เมื่อดูจากโครงอิเล็กตรอนแล้ว 11Na: 2, 8, 1
ดังนั้นเมื่อปล่อย 1 อิเล็กตรอน อิเล็กตรอนตัวสุดท้ายจะเป็น 8 (ตามกฎออกเตต)
เนื่องจากการกำจัดอิเล็กตรอน 1 ตัวแล้ว Na ซึ่งเดิมเป็นกลางจะเปลี่ยนเป็นประจุ +1 (Na+)
ปฏิกิริยาของเขา:
Na → Na+ + e- (ซึ่งหมายความว่า Na สูญเสียอิเล็กตรอน 1 ตัว ดูอิเล็กตรอนทางด้านซ้ายของลูกศร)
อิเล็กตรอนประมาณ 1 อิเล็กตรอนที่ Na ปล่อยออกมา
อิเล็กตรอนที่ปล่อยออกมาจะถูกจับโดย Cl เนื่องจาก Cl มีเวเลนซ์อิเล็กตรอน 7 ตัว (อยู่ในกลุ่ม VIIA)
ดังนั้นเมื่อดูจากโครงอิเล็กตรอน 17Cl: 2, 8, 7 ดังนั้นถ้า Cl จับอิเล็กตรอนได้ 1 ตัว โครงของมันจะเปลี่ยนเป็น 2, 8, 8 โดยที่อิเล็กตรอนตัวสุดท้ายเป็น 8 นี่จึงเป็นไปตามกฎออคเต็ต
เนื่องจาก Cl จับอิเล็กตรอนได้ 1 ตัว ดังนั้น Cl ที่เดิมเป็นกลางจะเปลี่ยนเป็น -1 (Cl-)
ปฏิกิริยาของเขา:
Cl + e- → Cl- (ซึ่งหมายความว่า Cl รับ 1 อิเล็กตรอน ดูอิเล็กตรอนที่อยู่ทางด้านซ้ายของลูกศร)
ผลของการก่อตัวของ Na+ และ Cl- ตามกฎของคูลอมบ์ ประจุประเภทต่างๆ จะดึงดูดกัน
ดังนั้น Na+ จะจับกับ Cl- เมื่อมีแรงไฟฟ้าสถิต
Na+ + Cl- → NaCl
สำหรับรายละเอียดเพิ่มเติม ดูภาพด้านล่าง:
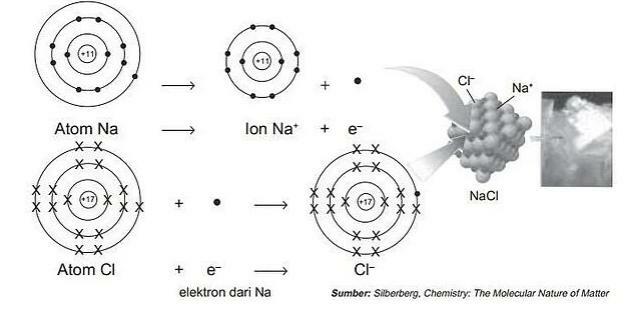
กระบวนการสร้างพันธะไอออนิกด้วย NaCl
จะเห็นได้ว่าองค์ประกอบคือ
พันธะไอออนิก = โลหะ + อโลหะ
หากเป็นลักษณะทั่วไป พันธะโลหะเหล่านี้รวมถึง:
- กลุ่ม IA (ยกเว้น H)
- IIA (ยกเว้น Be)
- IIIA (อลูมิเนียม)
- กลุ่มการเปลี่ยนผ่าน (กลุ่ม B)
สำหรับอโลหะ ได้แก่ :
- กลุ่ม IVA-VIIA
- ถ้า VIIIA ค่อนข้างเสถียร
ตัวอย่าง:
- K2O มีพันธะไอออนิก เนื่องจาก K เป็นของโลหะ (กลุ่ม IA) และ O อยู่ในกลุ่มที่ไม่ใช่โลหะ (กลุ่ม VIA)
- CH4 ไม่มีพันธะไอออนิก เนื่องจาก C อยู่ในกลุ่มอโลหะ (กลุ่ม IVA) และ H ก็ไม่ใช่โลหะด้วย (กลุ่ม IA แต่สำหรับ H เป็นโควาเลนต์)
- KF มีพันธะไอออนิก เนื่องจาก K อยู่ในกลุ่มโลหะ (กลุ่ม IA) และ F อยู่ในกลุ่มที่ไม่ใช่โลหะ (กลุ่ม VIIA)
เอกลักษณ์ของพันธะไอออนิก

ต่อไปนี้เป็นคุณสมบัติเฉพาะบางประการของพันธะไอออนิก ได้แก่:
- สารประกอบไอออนิกสามารถนำไฟฟ้าได้ง่ายมากเมื่ออยู่ในสารละลาย
- พันธะไอออนิกถูกสร้างขึ้นหรือเกิดขึ้นระหว่างไอออนของโลหะ (ไอออนบวก) และไอออนที่ไม่ใช่โลหะ (ไอออนลบ)
- พันธะไอออนิกสามารถละลายได้ง่ายในน้ำและตัวทำละลายชนิดมีขั้วอื่นๆ
- สารประกอบไอออนิกมีแนวโน้มที่จะสร้างของแข็งผลึกที่มีจุดหลอมเหลวสูงมาก
- การตั้งชื่อพันธะไอออนิกอย่างง่ายเริ่มต้นด้วยชื่อของโลหะ ตามด้วยชื่อของอโลหะที่ประกอบเป็นโลหะ ตัวอย่าง: โซเดียมคลอไรด์
พันธะไอออนิกเกิดขึ้นเนื่องจากแรงดึงดูดระหว่างไอออนที่มีประจุบวกและไอออนที่มีประจุลบ
ตัวอย่างของพันธะไอออนิก
ตัวอย่างหนึ่งของพันธะไอออนิกที่มักพบในชีวิตประจำวันคือเกลือแกง
ในเกลือแกงจะมีสูตรทางเคมีคือ NaCl (โซเดียมคลอไรด์)
ใน NaCl ที่เป็นของแข็งจะมีพันธะระหว่าง Na+ ไอออนและ Clion โดยแรงไฟฟ้าสถิต จึงสามารถเรียกได้ว่าพันธะไอออนิก
รูปผลึกของ NaCl คือชุดของไอออน Na+ กับ Cl-ion Na+ หนึ่งตัวล้อมรอบด้วย Clion หกตัว และ Clion หนึ่งตัวล้อมรอบด้วย Na+ หกตัวดังแสดงในรูปด้านล่าง
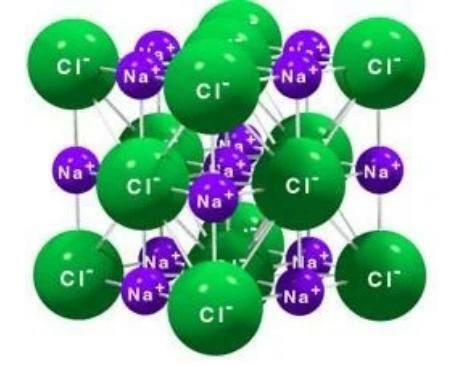
โครงสร้างรูปของ NaCl (1 Cl ล้อมรอบด้วย 6 Na และในทางกลับกัน 1 Na ล้อมรอบด้วย 6 Cl)
