Faradays lagmaterial: ljud, formler, exempelproblem
Läser in...
Vet du vad Faradays lag är? En av lagarna relaterar till elektromagnetism och ger förutsägelser om interaktioner mellan elektriska kretsar och magnetfält så att de kan producera elektromotoriska krafter.
Upptäcktes 1833 av den brittiske forskaren Michael Faraday, tills nu används den fortfarande och är mycket användbar inom vissa områden. Vill du veta vad det betyder och ett exempel på frågan?
Innehållsförteckning
Faradays första lag

Det finns två Faradays lagar, den första relaterar till processen för elektrolys och elektrisk laddning.
Det lyder "Massan av ämnet som produceras från en elektrod under elektrolysprocessen kommer att vara direkt proportionell mot mängden elektrisk laddning som används"
Ekvationerna som används är:
W Q
W = massan av ett ämne
Q = elektrisk laddning av elektroner
Användningsområdena är:
Q = i x t
i = elektrisk ström (i ampere)
t = tid (i sekunder)
Med förklaringen att summan av användningen av elektriska laddningar blir resultatet lika med produkten av strömstyrkan med tiden.
Dessutom finns det fler likheter från resultaten av användningen av lagen ovan, som blir:
w I x ta
När det gäller formeln som används i sin ansökan är:
W = e.i.t/F
Information:
W = massan av ett ämne som produceras i en elektrolysprocess (i gram)
e = ekvivalent massa
i = strömstyrka (i ampere)
t = tid (i sek)
F = Faradays bestämning med ett bestämt antal av 96 500 Coulomb/mol.
Tillämpningen av Faradays lag i kemins värld kan ses genom flera komponenter relaterade till elektrisk ström och elektrolys.
Som i den elektriska generatorn, som är en speciell anordning med funktionen att generera elektrisk energi genom mekaniska källor och utnyttja elektromagnetisk induktion. Generatorer har två typer, nämligen strömmen flyter fram och tillbaka och direkt.
Nästa applikation är en dynamo som har två typer, nämligen växelström och likström.
Läsa: Kirchhoffs lag
Faradays andra lag

I motsats till Faradays 1:a lag finns det ytterligare en sekund med ljudet "The massa av substansen som produceras av en elektrod under elektrolysprocessen, kommer att vara direkt proportionell mot den ekvivalenta massan av ämnet de.
Medan vad som menas med massan av ett ämne är massan av ett ämne som är i en tillämpning av lagen. Då är den ekvivalenta massan massan av ett ämne, stökiometriskt har samma antal mol som 1 mol av en elektron.
Ekvationen är:
Massa av ämne massa ekvivalent med ämne
w JAG
ME = oxidationstillstånd eller laddning av jonen/Ar
Formeln som används vid tillämpningen av denna andra lag är:
Wl/W2 = el/e2
Information:
W1 = massan av det första ämnet (i gram)
W2 = massan av det andra ämnet (i gram)
e1 = ekvivalent massa av det första ämnet
e2 = ekvivalent massa av det andra ämnet
Vid tillämpningen av denna andra lag är den ekvivalenta massfunktionen mycket viktig. Delat med förändringen i oxidationstal som sker i en elektrolysreaktion.
Ekvationen är:
Mek = Ar
Ändring av oxidationstal
När man hänvisar till grundläggande stökiometriska begrepp, finns det ett samband mellan massa, antalet mo och molarens massa, vilket kommer att vara nära relaterat till den kombinerade användningen av Faradays 1:a och 2:a lag.
Ekvationen är:
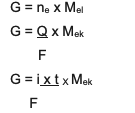
Sammanfattningen är den kombinerade ekvationen mellan och 2, nämligen:
Annons
G ~ i x t x Mek
Information:
G = produktens massa (i gram)
Q = elektrisk laddning (i coulomb-enheter)
i = styrkan av elektrisk ström (i ampere)
t = tid (i sek)
Mek= ekvivalent massa av ämnet (i gram/mol)
F = Faradays konstant som är 96 500 coulomb/mol)
Läsa: Hookes lag
Exempel på Faradays lagproblem
För att bättre förstå tillämpningen av Faradays lag, här är några exempel på dess tillämpning.
1. Exempel 1
Det har skett en Cu-deposition i en elektrisk krets med en magnitud på 5 gram. Vilken massa Ag har fällts ut vid elektroderna? För ytterligare information Ag = 108 och Cu = 63,5.
För att formeln ska hitta massan av Ag eller WAg du kan använda följande formel:
WCu = JAGCu
WAg= JAGAg
ME är känd genom ekvationen = Ar
Oxidationstal = 2
Är känd:
WCu = 5 gram
Beräkna först ME för de två ämnena genom att använda reduktionsreaktionerna för både Cu och Ag enligt följande:
Cu2+ + 2e– → Cu(s), MEcu
= Ar = 63,5
Oxidationstal =2
= 31,75
Ag+ + e– → Ag(s) MEAg
= Ar = 108
Oxidationstal = 1
= 108
nästa 5gCu = 31.75
WAg 108
= 17
Så massan av Ag som sätter sig är = 17 gram.
2. Exempel 2
Hur många Faradays tar det för att reducera Ca-joner?2+ med mängden 12 gram? Här är diskussionen:
Ca2+→ valensen är 2
Ar av Ca är 40
Formeln som används är W = e x F
Var hittar man F = W/e
Svaret är:
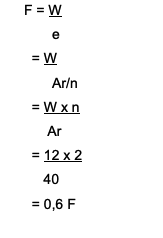
Så det tar 0,6 Faraday att reducera Ca-joner2+ vilket uppgår till 12 gram.
Läsa: Coulombs lag
3. Exempel 3
En elektrisk ström på 0,2 ampere får flyta under en period av 50 minuter och kommer sedan in i elektrolyscellen som innehåller en CuCl-lösning.2. Vad är mängden Cu-fällning som kommer att bildas vid katoden. Som ytterligare information Ar från Cu = 63,5
Är känd:
Ström med symbol I = 0,2 ampere
Tid med symbolen t = 50 minuter, om den används som sekunder är 50 x 60 sekunder, vilket är 3 000 sekunder
Frågade: WCu?
Svar: Skriv först ner Cu-reduktionsreaktionen, nämligen:
Cu2+ (aq) + 2e+ → Cu(s)
MIGCu = Ar
Oxidationstal = 63,5/2
= 31,75
Formeln som används för att hitta Wcu är:
Wcu = (1/96 500) x i x t x MEcu
= (1/96 500) x 0,2 A x 3 000 s x 31,75
= 0,197 gram
Så, värdet på Cu-avsättning som inträffar är 0,197 gram.
4. Exempel 4
I en elektrolys med en elektrod av koltyp kunde den producera en fällning av Cu-typ med en mängd av 12,7 gram. Använder en elektrisk ström på 4 ampere. Hur lång tid tar det för elektrolysen?
Är känd:
Ar av Cu = 63,5
Frågade: W?
Svar:

Så tiden för elektrolys är 9 650 sekunder med formeln från Faradays lag som gäller.
För er som läser kemi behöver ni förstås verkligen ha en ordentlig förståelse för Faradays lag. Så att när du får en uppgift relaterad till tillämpningen av lagen kan du svara på den korrekt och grundligt med hjälp av de formler som redan finns tillgängliga.
X STÄNG
Annonser
ANNONS
X STÄNG
