Пример проблема молалитета: молска фракција, формула и решење
Пример проблема молалитета: молска фракција, формула и решење – У овој прилици О кнов.цо.ид ће разговарати о молалности са неколико примера питања и наравно о другим стварима које га такође покривају. Хајде да заједно погледамо дискусију у чланку испод да бисмо је боље разумели.
Пример проблема молалитета: молска фракција, формула и решење
Молалитет или молална концентрација је мера концентрације растворене супстанце у раствору у смислу количине супстанце у одређеној маси растварача. Ово се разликује од дефиниције моларности која се заснива на одређеној запремини раствора.
Уобичајена јединица молалитета у хемији је мол/кг. Раствор са концентрацијом од 1 мол/кг се такође понекад изражава као 1 молал. Термин молалност се формира аналогно моларности која је моларна концентрација раствора.
Молалност раствора се може испитати додавањем неког растварача. Једноставније, молалитет (м) раствора је мол раствора подељен са килограмима растварача. Молалност или молалност је концентрација раствора која наводи број молова (н) растворене супстанце у 1 кг или 1000 грама растварача.
Разлика између молалности и моларности је у томе што ако је молалитет молалитет или молална концентрација (м) изражава број молова растворена у 1000 грама растварача, док је моларност изјава о броју молова растворене супстанце у сваком литру решење. Моларност је представљена ознаком М, а јединице су мол/литар.
Формула молалитета
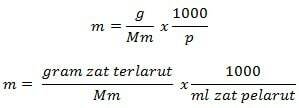
Информације
м = молалитет (мол/кг)
г = грама растворене супстанце (г)
Мм = моларна маса супстанце (г/мол)
П = маса растварача (г)
Однос молалитета са процентом масе
Масени проценат је јединица концентрације која се обично користи у хемијским растворима. Примери раствора које можемо наћи свакодневно су 75% раствор алкохола и 24% раствор сирћетне киселине. Масени проценат је број грама растворене супстанце у 100 грама масе раствора. Једначина која показује израчунавање процента масе је следећа:

Однос молалитета са моларношћу
Моларност изражава број молова растворене супстанце у једном литру раствора. Моларност се може претворити у молалност претварањем запремине раствора у масу раствора. За претварање запремине у масу потребни су подаци о густини раствора (п), који се могу формулисати на следећи начин:

Моле Фрацтион
Молска фракција је мера концентрације раствора која изражава однос броја молова у неким супстанцама према укупном броју молова присутних у компонентама раствора. Молна фракција је подељена на 2 дела:
Молна фракција растворене супстанце (Кст)
Формула за молску фракцију растворене супстанце (Кст), наиме:

информације:
Кст = молска фракција растворене супстанце
Нт = број молова растворене супстанце
Нп = број молова растварача
Молна фракција растварача (Ксп)
Формула за молску фракцију растварача (Ксп), односно:

Информације
Ксп = молска фракција растварача
Нт = број молова растворене супстанце
Нп = број молова растварача
Збир молних фракција растворене супстанце и растварача је 1
Кст + Ксп = 1
Примери проблема и решења молалитета
Проблем 1
Колики је молалитет раствора који садржи 4 г НаОХ (Ар На = 23 г/мол, Ар О = 16 г/мол и Ар Х = 1 г/мол) раствореног у 250 г воде?
Завршетак:
Познат као:
маса НаОХ = 4 гр
АрНа = 23 гр/мол
АрО = 16 г/мол
АрХ = 1 гр/мол
маса воде = 250 гр = 0,25 кг
Упитан: м = ?
Одговор:
Господин. НаОХ = 40 гр/мол
број молова НаОХ = маса/Мр
број молова НаОХ = 4 гр/(40 гр/мол)
број молова НаОХ = 0,1 мол
м = број молова/п
м = 0,1 мол / 0,25 кг
м = 0,4 м
Проблем 2
Колики је молалитет 37% (в/в) раствора ХЦл? (Ар Х = 1 г/мол, Ар Цл = 35,5 г/мол)
Завршетак:
Познат као:
маса ХЦл = 37%
АрХ = 1 г/мол
АрЦл = 35,5 г/мол
Упитан: м = ?
Одговор:
Господин. ХЦл = 36,5 гр/мол
Претпоставимо да је маса раствора 100 грама онда је маса ХЦл:
ХЦл маса = 37% к 100 гр
маса ХЦл = 37 гр
маса растварача = маса раствора – маса ХЦл
маса растварача = 100 гр – 37 гр
маса растварача = 63 гр = 0,063 кг
број молова ХЦл = маса/Мр
број молова ХЦл = 37 гр /(36,5 гр/мол)
број молова ХЦл = 1,01 мол
м = број молова/маса растварача
м = 1,01 мол/0,063 кг
м = 16,03 м
Проблем 3
Одредити молалитет раствора припремљеног растварањем 12 грама урее ЦО(НХ2)2 у 250 грама воде.
Завршетак:
Познат као:
маса урее = 12 гр
Мр Уреа = 60 г/мол
маса растварача = 250 гр = 0,25 кг
Упитан: м = ?
Реклама
Одговор:
број молова урее = маса/г
број молова урее = 12 гр /(60 г/мол)
број молова урее = 0,2 мола
м = број молова/маса растварача
м = 0,2 мол / 0,25 кг
м = 0,8 м
Проблем 4
Колики је молалитет алкохолног раствора који садржи 23 масених % етанола (Мр = 46)?
Одговор:
Познат као:
маса етанола = 23 %
Мр етанол = 46 г/мол
Упитан: м = ?
Завршетак:
на пример, маса раствора алкохола је 100 грама, тада је маса етанола:
маса етанола = 23% к 100 гр
маса етанола = 23 гр
маса растварача = маса раствора – маса етанола
маса растварача = 100 гр – 23 гр
маса растварача = 77 гр = 0,077 кг
број молова етанола = маса/Мр
број молова етанола = 23 гр /(46 г/мол)
број молова етанола = 0,5 мол
м = број молова/маса растварача
м = 0,5 мол /0,077 кг
м = 6,49 м
Проблем 5
Израчунајте концентрацију (% по маси) глукозе у 2 молалном раствору глукозе.
Завршетак:
Познат као:
м = 2 молал = 2 мол/кг = 0,002 мол/гр
Мр глукоза = 180 гр/мол
Питао: маса глукозе (%) = ?
Одговор:
молови глукозе = маса/г
мол глукозе = маса глукозе/(180 г/мол)
мол глукозе = маса глукозе к 0,005 мол/гр
Замените молове глукозе у следећу једначину:
м = мол глукозе/маса растварача
0,002= маса глукозе к 0,005/маса растварача
о, оо2/о, оо5 = маса глукозе/маса растварача
2/5 = маса глукозе/маса растварача
Дакле, масени однос глукоза: маса растварача = 2:5, док је масени однос глукоза: маса раствора = 2:7.
Тако,
% маса глукозе = (маса глукозе/маса раствора) к100%
% по маси глукозе = (2/7) к 100%
% масе глукозе = 28,57 %
Проблем 6
Колики је молалитет раствора који садржи 8 г НаОХ (Ар На = 23 г/мол, Ар О = 16 г/мол и Ар Х = 1 г/мол) раствореног у 250 г воде?
Дискусија
Познат као:
Маса НаОХ = 8 гр
АрНа = 23 гр/мол
АрО = 16 г/мол
АрХ = 1 гр/мол
маса воде = 250 гр = 0,25 кг
Тражи се: молалитет (м)….?
Одговор:
Господин. НаОХ = 40 гр/мол
Број молова НаОХ = маса/Мр
Број молова НаОХ = 8 гр/(40 гр/мол)
Број молова НаОХ = 0,2 мол
м = број молова/п
м = 0,2 мол / 0,25 кг
м = 0,8 м
Проблем 6
Одредити молалитет раствора припремљеног растварањем 15 грама урее ЦО(НХ2)2 у 250 грама воде.
Дискусија
Познат као:
Маса урее = 15 гр
Мр Уреа = 60 г/мол
Маса растварача = 250 гр = 0,25 кг
Траже се: молалитет (м)…. ?
Одговор:
Број молова урее = маса/г
Укупни мол урее = 15 гр / 60 г/мол
Број молова урее = 0,25 мол
м = број молова/маса растварача
м = 0,25 мол / 0,25 кг
м = 1 м
Проблем 7
Колики је молалитет 37% (в/в) раствора ХЦл? (Ар Х = 1 г/мол, Ар Цл = 35,5 г/мол).
Дискусија
Познат као:
маса ХЦл = 37%
АрХ = 1 г/мол
АрЦл = 35,5 г/мол
Тражи се: молалитет (м)…?
Одговор:
Господин. ХЦл = 36,5 гр/мол
Претпоставимо да је маса раствора 100 грама, онда је маса ХЦл:
ХЦл маса = 37% к 100 гр
маса ХЦл = 37 гр
маса растварача = маса раствора – маса ХЦл
маса растварача = 100 гр – 37 гр
маса растварача = 63 гр = 0,063 кг
број молова ХЦл = маса/Мр
број молова ХЦл = 37 гр /(36,5 гр/мол)
број молова ХЦл = 1,01 мол
м = број молова/маса растварача
м = 1,01 мол/0,063 кг
м = 16,03 м

Проблем 8
Одредити количину (граме) НаОХ која се мора растворити у 1 литру воде (вода = 1,00 г/мЛ) да би се добило 0,25 м НаОХ.
Дискусија
Познат као:
1 Л воде = 1000 мЛ = 1000 г (пошто ρ воде = 1,00 г/мЛ)
мНаОХ = 0,25 м
Мр НаОх = 40
Упитан: гр…?
Одговор:
мНаОХ = гр / Мр к 1.000 / П
0,25 = гр/40 к 1.000/1.000
0,25 = г/40
г = 0,25 к 40
г = 10 грама
Дакле, потребна количина НаОХ је 10 грама.
Проблем 9
Одредити колико мЛ воде је потребно да се раствори 4,9 грама Х2СО4 чија је концентрација 0,25 М (Ар Х = 1; С = 32; О =16)!
Дискусија
Познат као:
мХ2СО4 = 0,25
Мр Х2СО4 = 98
гр = 4,9 грама
Питао :п???
Одговор:
м = гр/Мр к 1,000/П
0,25 = 4,9/98 к 1000/стр
п = 20 грама (20 мЛ)
Дакле, запремина воде је 20 мЛ.
Проблем 10
Која је маса воде потребна за припрему раствора од 1,2 м од 0,6 мол НаЦл?
Дискусија
молалитет (м) = 1,2 мм =
нП
1,2 =
0,6П
П=
0,61,2
= 0,5 кг
Дакле, потребна маса воде (масе растварача) је 0,5 кг
Проблем 11
Претпоставимо да су 2 мола растворене супстанце растворена у 1 литру растварача, колики је молалитет?
Дискусија
растворени молови (н) = 2 молм =
нП
м =
21
= 2м
Израчунајте молалитет 25 грама КБр (Мр = 119) раствореног у 750 мЛ чисте воде.
Дискусија
растворена материја = 25 грама
Мр = 119
растварач (П) = 750 мЛ = 750 грама (јер ρ воде = 1,00 г/мЛ) = 0,75 кгн =
растворена супстанцагосподин
н =
25119
= 0,21 мол
м =
нП
м =
0,210,75
= 0,28 м
Тако је преглед из О кнов.цо.ид О томе Пример проблема молалитета , надамо се да може допринети вашем увиду и знању. Хвала вам што сте посетили и не заборавите да прочитате друге чланке.
Списак садржаја
Препорука:
- Целулоза је: дефиниција, тип, структура, својства и… Целулоза је: дефиниција, врста, структура, својства и функције - Целулоза је једињење налик влакнима и налази се у заштитним ћелијским зидовима биљака. Да бисмо боље разумели, наравно, разговараћемо о…
- √ Дефиниција експанзије у дужини, формули, површини и запремини супстанце… Дефиниција дугог ширења, формуле, површине и запремине чврстих тела - У овој дискусији ћемо објаснити дуго ширење. Што укључује појам дуге експанзије, формуле дуге експанзије, површине, запремине материје...
- Мере: дефиниција, конверзија јединица дужине, како… Мерна лествица: дефиниција, конверзија јединица дужине, како се користи и примери питања - шта је у шта подразумевате под мердевинама величине и како их користити?, овог пута ће кнов.цо.ид дискутуј о томе...
- Ковалентне везе: дефиниција, карактеристике, типови, формуле… Ковалентне везе: дефиниција, карактеристике, типови, хемијске формуле и својства једињења - Шта је ковалентна веза? Овом приликом, Сепутаркновледге.цо.ид ће разговарати о томе, а наравно и о другим стварима покрио га. Дозволити…
- Говор о животној средини: дефиниција, сврха, карактеристике и… Говор о животној средини: дефиниција, сврха, карактеристике и примери – Како је структуриран текст еколошког говора? шта је добро и исправно?, Овом приликом, Сепутаркновледге.цо.ид ће разговарати о томе и наравно стварима Која…
- Формуле конуса, карактеристике, својства, елементи и примери задатака Формуле конуса, карактеристике, својства, елементи и примери Проблем - Како израчунати површину и запремину облика цоне спаце?, Овом приликом, Сепутаркновледге.цо.ид ће разговарати о томе и наравно о другим стварима Која…
- Формула вискозитета: Дефиниција вискозитета, коефицијента и… Формула вискозитета: дефиниција вискозитета, коефицијент и фактори који утичу - како је формула вискозитета Вискозитет је мерење отпора флуида који се мења било напрезањем или под притисак. Овом приликом, Сепутаркновледге.цо.ид…
- Јединица тежине: дефиниција, лествица конверзије и примери… Јединица тежине: дефиниција, лествица конверзије и пример проблема - Шта је јединица тежине?, овом приликом О кнов.цо.ид ћемо разговарати о томе, укључујући разумевање и наравно и друге ствари покрио га. Дозволити…
- Момент инерције: дефиниција, фактори, једначине облика… Момент инерције: дефиниција, фактори, једначине у облицима објеката и примери задатака - шта се подразумева са Моментом инерције?, Овом приликом ће Се у вези са кнов.цо.ид разговарати о томе и наравно о ствар…
- Равномерно променљиво кружно кретање: дефиниција, величина… Равномерно променљиво кружно кретање: дефиниција, физичка количина, формуле и примери проблема - шта је кретање Редовне кружне промене и примери? Овом приликом, Сепутаркновледге.цо.ид ће разговарати о томе и наравно о...
- Неодређени интеграл: дефиниција, формуле, својства и примери… Неодређени интеграл: дефиниција, формуле, својства и примери проблема - шта се подразумева под неодређеним интегралом Наравно и како израчунати математичке операције? воља…
- Дефиниција метода учења: карактеристике, сврха, врсте и… Дефиниција метода учења: карактеристике, сврха, врсте и дискусија – шта се подразумева под методом Учење?, Овом приликом, Сепутаркновледге.цо.ид ће разговарати о томе и наравно о другим стварима Такође…
- Хемијска равнотежа: дефиниција, закони, формуле, примери задатака Хемијска равнотежа: дефиниција, закони, формуле, примери проблема - У овој дискусији ћемо објаснити о хемијској равнотежи, закону формуле и опремљен примерима хемијске равнотеже са потпуном и...
- Решења киселинске базе: дефиниција, теорија киселих база, својства и… Решења киселина и база: дефиниција, теорија киселина и база, својства и типови - Киселински и базни раствори су две групе хемијских једињења која се широко налазе и користе у свакодневном животу.
- Изградите простор – дефиниција, формуле и различити… Изградња простора – дефиниција, формуле и њени различити типови – Овом приликом желимо да прегледамо математички материјал о геометријским облицима, како из разумевања тако и из других. Одмах да разговарамо...
- √ ацидо-базни индикатор: дефиниција, типови и примери Индикатори киселина и база: дефиниција, типови и примери - Овом приликом, Ароунд Кновледге ће разговарати о ацидо-базним индикаторима. Што у овој дискусији објашњава значење индикатора киселине...
- Бојлов закон: дефиниција, формуле, примене и примери… Бојлов закон: дефиниција, формуле, примене и примери проблема - У овој дискусији ћемо објаснити Бојлов закон. Што укључује значење Бојловог закона, формуле Бојловог закона, примену…
- Мотивационе кратке приче: дефиниција, савети за писање и примери Мотивационе кратке приче: дефиниција, савети за писање и примери - шта је мотивациона кратка прича?, на Овом приликом, Сепутаркновледге.цо.ид ће разговарати о томе да ли је то Кратка прича о пријатељству и другим стварима о томе. Хајде да видимо…
- Дефиниција притиска: врсте притиска, формуле и примери задатака Дефиниција притиска: врсте притиска, формуле и примери задатака - Шта је притисак? Овом приликом, око знања.цо.ид, разговараћемо о томе шта је притисак, а шта други елементи покрио га. Хајде да видимо…
- Динамички флуиди: врсте, карактеристике, Бернулијева једначина, теореме… Динамички флуиди: врсте, својства, Бернулијева једначина, Торичелијева теорема, формуле и примери задатака - шта је то динамичке течности и њихове врсте? О томе…
- Густина воде: дефиниција, формуле и примери Густина воде: дефиниција, формуле и примери - Колика је густина воде? Да видимо заједно…
- Дефиниција количине, јединице, мере и примери… Дефиниција количине, јединице, мерења и примера (комплетно) - У основним концептима физике, сигурно смо упознати са нечим што се односи на свакодневни живот. Као мерење висине, мерење масе, мерење ширине, ...
- Примери научног рада: функције и правила језика Примери научних радова: функције и правила језика – Који су примери добрих и исправних облика писања научних радова? Раније је Сепутар тхе кновледге.цо.ид расправљао о научном раду: дефиниција, карактеристике, предности,…
- Примери равних облика: врсте, карактеристике и формуле равних облика Примери равних облика: врсте, својства и формуле равних облика – Који су примери равних облика?
- Примери питања из физичког васпитања за 11. и 2. семестар СМА/МА/СМК разреда 11 (КСИ) Примери питања из физичког васпитања за класу 11 (КСИ) за СМА/МА/СМК семестар 1 и 2 (2019. и 2020.) - Овом приликом, Сепутаркновледге.цо.ид ће разговарати о примерима питања из физичког васпитања за 11. разред са више избора и есеја ...
- Падавине су: 12 дефиниција према стручњацима, врстама,… Падавине су: 12 дефиниција према типовима стручњака и факторима - У овој дискусији, Око знања ће објаснити падавине. Падавине су климатски догађај који је природан,...
- √ Дефиниција хемијских једињења, карактеристика, типова и номенклатуре… Дефиниција хемијских једињења, карактеристике, типови, комплетна номенклатура - У овој дискусији ћемо објаснити хемијска једињења. Покрива дефиницију, карактеристике, типове и номенклатуру хемијских једињења са дискусијом...
- Појединачне супстанце су: дефиниција, елементи и једињења Појединачне супстанце су: дефиниције, елементи и једињења – Шта значи појединачна супстанца? Хајде да заједно погледамо дискусију...
- Коса раван: дефиниција, формуле, механичка предност и… Коса раван: дефиниција, формуле, механичке предности и примери проблема - Шта се подразумева под равнином коси и како израчунати физику? природно…
- Конверзија јединица: дефиниција, фактор, дужина, маса, време,… Конверзија јединица: дефиниција, фактор, дужина, маса, време, запремина и притисак - Шта је конверзија јединица?, Овом приликом, Сепутаркновледге.цо.ид ће разговарати о томе, укључујући факторе, типове и наравно друге ствари Која…
