Oksidacijske številke: opredelitev, pravila določanja in primeri problemov
Oksidacijske številke: opredelitev, pravila določanja in primeri problemov - Kaj je oksidacijsko število in primer? Ob tej priložnosti O Knowledge.co.id bo razpravljal o tem in seveda o drugih stvareh, ki ga prav tako obkrožajo.
Oglejmo si razpravo v spodnjem članku, da jo bomo bolje razumeli
Kazalo
-
Oksidacijske številke: opredelitev, pravila določanja in primeri problemov
- Pravila za določanje oksidacije
- Primeri oksidacijskih števil
- Deliti to:
- Sorodne objave:
Oksidacijske številke: opredelitev, pravila določanja in primeri problemov
Oksidacijsko število ali oksidacijsko stanje je število negativnih in pozitivnih nabojev v atomu, kar posredno kaže na število elektronov, ki so bili sprejeti ali predani drugim atomom. Nekateri atomi imajo samo eno oksidacijsko stanje, nekateri pa imajo več kot eno oksidacijsko stanje.
Če najdete vrednost atomskega števila v molekuli ali spojini, morate najprej poznati oksidacijsko stanje atomov drugih elementov, ki imajo splošne (standardne) lastnosti.
Pravila za določanje oksidacije
Za določitev oksidacijskega števila (Biloks) v ionu ali drugih spojinah je treba upoštevati spodnja pravila:
-
Stanje oksidacije prostega elementa v obliki atoma ali molekule elementa ima vrednost 0 (nič).
Prosti elementi v obliki atomov so:
- Oksidacijsko stanje C pri C je = 0
- Oksidacijsko stanje Ca v Ca je = 0
- Oksidacijsko stanje Cu na Cu je = 0
- Oksidacijsko stanje Na v Na je = 0
- Oksidacijsko stanje Fe v Fe je = 0
- Oksidacijsko število Al v Al je = 0
- Oksidacijsko stanje Ne v Ne je enako 0
Prosti elementi v obliki molekul so:
- H oksidacijsko stanje H2 je = 0
- Oksidacijsko stanje O v O2 je = 0
- Oksidacijsko stanje Cl v Cl2 je = 0
- Oksidacijsko stanje P v P4 je = 0
- Stanje oksidacije S v S8 je = 0
-
Stanje oksidacije kovine v spojini je vedno pozitivno.
V skupini 1 kovinski elementi (stari sistem Gol. IA) (Li, Na, K, Rb, Cs, Fr), njegovo oksidacijsko stanje je +1.
- Stanje oksidacije K v KCl, KNO3 ali K2SO4 je = +1
V skupini 2 kovinski elementi (stara sistemska skupina. IIA) (Be, Mg, Ca, Sr, Ba, Ra), njegovo oksidacijsko stanje je +2.
- Oksidacijsko stanje Mg v MgO, MgCl2 ali MgSO4 je = +2
Oksidacijska števila (Biloks) drugih kovinskih elementov so:
- Ag je vreden = +1
- Cu je vreden = +1 in +2
- Hg je vredno = +1 in +2
- Au je vreden = +1 in +3
- Fe je vreden = +2 in +3
-
Oksidacijsko število (Bilox) enoatomskih (za 1 atom) in večatomskih (več kot 1 atom) ionov je enako v naboju ionov.
-
Stanja oksidacije monatomskih ionov so Na +, Ca2 +, Al3 +, Cl– in 02- + 1, + 2, +3, -1 in -2.
- Oksidacijska stanja polihatomskih ionov so NH4 +, SO42-, PO43-, +1, -2 in -3.
-
-
Oksidacijsko število elementov skupine VIA (O, S, Se, Te, Po) v binarnih spojinah je -2, elementov skupine VIIA (F, Cl, Br, I, At) v binarnih spojinah pa -1.
-
Stanje oksidacije elementa S v Na2S in MgS je = -2.
- Oksidacijsko stanje elementa Cl v NaCl, KCl, MgCl2 in FeCl3 je = -1.
-
-
Oksidacijsko število elementa H v njegovih spojinah je = +1.
Razen stopnje oksidacije hidridov (vodikove spojine s kovinami) je vrednost = -1.
Ker v hidridih vodik obstaja v obliki hidridnega iona, H–. Stanje oksidacije iona, kot je hidrid, je enako kot naboj na ionu, ki je = -1.
- Oksidacijsko stanje elementa H v H2O, HCl, H2S in NH3 je = +1.
- Oksidacijsko število elementa H v NaH, CaH2 in AlH3 je = -1.
-
Oksidacijsko število elementa O v njegovi spojini je -2, razen,
-
Oksidacijsko število binarne spojine v F je = +2.
- Oksidacijsko stanje peroksidnih spojin, kot so H2O2, Na2O2 in BaO2, je = -1.
- Stanje oksidacije superoksidnih spojin, kot sta KO2 in NaO2, je = -½.
- Oksidacijsko število (Biloks) elementa O v H2O, KOH, H2SO4 in Na3PO4 je = -2
-
-
Vsota oksidacijskih števil elementov v spojini je 0 (nič).
Vsota oksidacijskega števila elementov, ki tvorijo ione ali večatomske spojine, je enaka naboju na samem poligatnem ionu.
-
Oksidacijsko število kisika (O) v peroksidni spojini = -1. Oksidacijsko število O v neperoksidnih spojinah = -2.
Primer:
O oksidacijsko stanje v BaO2 = -1.
Atom Ba je kovinski element skupine IIA, zato je oksidacijsko stanje Ba = +2. Vsota oksidacijskih stanj Ba in O mora biti 0 (točka 6 pravila oksidacije). Zato mora biti stopnja oksidacije O -2. Ker ima atom O indeks 2, je oksidacijsko stanje O: indeks O = -2: 2 = -1. Dokazano je, da oksidacijsko stanje O v BaO2 je -1.
Primeri oksidacijskih števil
Primer 1. vprašanja
Določite oksidacijsko število elementov krepko v naslednjih spojinah:
- N2O5
- MnO4–
- Al2(Torej4)3
Odgovor:
Določi se oksidacijsko stanje, na primer x:
- 1. Napolnite N2O5 tj. (2 x oksidacijsko stanje N) + (5 x oksidacijsko stanje O)
0 = (2x (x)) + (5 x (-2))
0 = 2x - 10
x = +5
Torej je oksidacijsko število atoma N v spojini N2O5 +5
- 2. Polnjenje MnO4– je (1 x oksidacijsko število Mn) + (4 x oksidacijsko stanje O), kot sledi!
-1 je (1 x (x)) + (4 x (-2))
-1 je x - 8
x je +7
Torej je oksidacijsko število atoma Mn v spojini MnO4– to je +7
- 3. Al obremenitev2(Torej4)3 = (2 x oksidacijsko stanje Al) + (3 x oksidacijsko stanje S) + (12 x oksidacijsko stanje O), je:
0 = (2 x (+3)) + (3 x (x)) + (12 x (-2))
0 = 6 + 3x -24
x = +6
Torej je oksidacijsko število atoma S v spojini Al2(Torej4)3 to je +6.
Primer 2. vprašanja
Takoj za primer problema z oksidacijskimi številkami, in sicer v 'Kakšno je oksidacijsko število atoma C v oksidacijskem številu v CH4 s pravilom oksidacijskega števila H = +1?
Odgovor:
Oxx od H x Število atomov H = + '1 x 4 = +4
Oxx C x Število atomov C = a x 1 = a
Če je iz spojine gledano nevtralna spojina, mora biti število oksidacijskih elementov v njej nič, kar pomeni:
a + (+4) = O
a = -4
Torej je oksidacijsko število C v spojini CH4 -4.
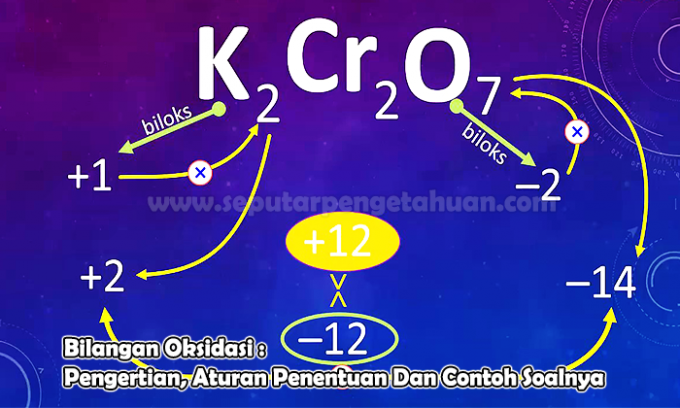
Primer 3. vprašanja
Določite oksidacijsko število elementa N v naslednjih spojinah:
N2O5
Odgovor:
Stopnja oksidacije bo označena z X
Napolnite N2O5 tj. (2 x oksidacijsko stanje N) + (5 x oksidacijsko stanje O)
0 = (2 x (x)) + (5 x (-2))
0 = 2x - 10
x = +5
Torej, oksidacijsko število atoma N v spojini N je2O5 to je +5.
To je pregled od O Knowledge.co.id približno Oksidacijske številke: opredelitev, pravila določanja in primeri problemov, Upajmo, da bo lahko prispeval k vašemu uvidu in znanju. Hvala za obisk in ne pozabite prebrati drugih člankov.
Preberite tudi:BMKG: Definicija, zgodovina, položaj in dejavnosti
