Boyleov zakon: definicija, formule, aplikacije, primeri problemov
Boyleov zakon: opredelitev, formule, aplikacije in primeri problemov - V tej razpravi bomo razložili o Boylovem zakonu. Kar vključuje razumevanje Boylovega zakona, Boylove zakonske formule, uporabo Boylovega zakona in primere vprašanj iz Boylovega zakona, o katerih se razpravlja v celoti in lahkotno. Za več podrobnosti natančno preberite spodnja mnenja.
Kazalo
-
Boyleov zakon: opredelitev, formule, aplikacije in primeri problemov
- Opredelitev Boylovega zakona
- Boylova zakonska formula
- Uporaba Boyleovega zakona
- Primer Boyleovega zakona
- Deliti to:
- Sorodne objave:
Boyleov zakon: opredelitev, formule, aplikacije in primeri problemov
Najprej se pogovorimo o Boylovem zakonu.
Opredelitev Boylovega zakona
Boylov zakon je eden od fizikalnih zakonov, ki razpravlja o razmerju med tlakom in prostornino v plinu. Robert Boyle je leta 1627-1691 odkril Boyleov zakon, izvedel je študijo, da bi ugotovil razmerje med tlakom in prostornino plina pri stalni temperaturi. Robert Boyle je iz svoje raziskave ugotovil, da sta zmnožek tlaka in prostornine plina v zaprtem prostoru konstantna.
Po Wikipediji je še ena opredelitev Boylovega zakona eden od mnogih kemijskih zakonov in poseben primer idealnega kemijskega zakona. Če temperatura ostane v zaprtem sistemu konstantna, Boylov zakon opisuje obratno razmerje med absolutnim tlakom in prostornino zraka.
Boyleov zakon, ki ga je odkril Robert Boyle, preučuje vpliv tlaka na prostornino plina pri konstantni temperaturi. Ta izjava Roberta Boylea se imenuje Boylov zakon in se glasi:
"Pri konstantni temperaturi je tlak plina v zaprtem prostoru obratno sorazmeren njegovi prostornini."
V vsakdanjem življenju pogosto srečamo primere orodij, ki delujejo po Boyleovi zakonodaji, vključno s kolesarskimi črpalkami, brizgami itd.

Boylova zakonska formula
Po Boylovem zakonu to pomeni, da je zmnožek tlaka in prostornine plina v zaprtem prostoru konstanten pri konstantni temperaturi plina.
Zgornja izjava, napisana v formuli, in sicer:
P.V = C
Kjer je C fiksno število (konstanta). Če se tlak spremeni, se bo spremenila tudi količina plina, potem lahko zgornjo formulo zapišemo na naslednji način:
P1. V1 = P2. V2
Preberite tudi:Inercijski trenutek: opredelitev, dejavniki, enačbe v obliki predmetov in primeri problemov
Pod pogojem:
P1 = začetni tlak plina (atm.cm Hg, N / m2, Pa)
P2 = končni tlak plina (atm, cm Hg, N / m2, Pa)
V1 = prvotna prostornina plina (m3, cm3)
V2 = končna prostornina plina (m3, cm3)
Boyleov zakon se uporablja le, če:
- Fiksna temperatura ali konstanta plina
- Plin je v zaprti sobi
- Brez kemične reakcije
- Brez sprememb v plinastem stanju
Uporaba Boyleovega zakona
Uporaba Boylovega zakona temelji na principu delovanja črpalke. Črpalka je naprava, ki se uporablja za transport plina / tekočine. V skladu s tem principom delovanja je črpalka razdeljena na dva dela, in sicer na sesalno črpalko in tlačno črpalko.
Po vdihu se količina zraka v črpalki poveča in zrak ne more vstopiti v pnevmatiko, ker mora zrak vstopiti skozi ventil (odzračevalnik) iz gume.
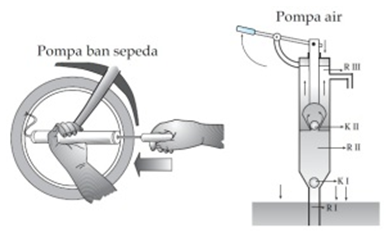
Če pritisnete dovod, se bo količina zraka v črpalki zmanjšala in s povečanjem tlaka lahko zrak vstopi v pnevmatiko skozi odzračevalno cev. Podobne naprave, ki uporabljajo Boyleov zakon, so brizge, pipete, tlačne črpalke in vodne črpalke.
Primer Boyleovega zakona
Sledijo primeri problemov v zvezi z Boyleovim zakonom:
1. Zaprta komora vsebuje plin s prostornino 200 ml. Če je sobni tlak 60 cmHg, potem izračunajte tlak plina v prostoru s prostornino 150 ml?
Rešitev:
Je znan:
V1 = 200 ml
P1 = 60 cmHg
V2 = 150 ml
Na vprašanje: P2…?
Odgovor:
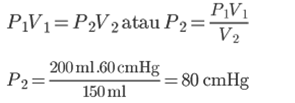
Po Boylovem zakonu je tlak plina v prostoru s prostornino 250 ml 80 cmHG.
2. V zaprtem prostoru, katerega prostornina je 0,2 m3, napolnjena s plinom, če se tlak poveča na 80 000 Pa?
Rešitev:
Je znan:
P1 = 60.000 Pa
V1 = 0,2 m3
P2 = 80.000 Pa vprašano: V2…?
Odgovor:
P1V1=P2 V2
V2 = (P1 V1): P2
V2 = (60.000 x 0,2): 80.000
V2 = 1,2/8
V2 = 0,15 m3 Torej, prostornina plina postane 0,15 M3
3. O Boyleovem zakonu, str. V = k, k ima dimenzije ...
A. Moč
B. Trud
C. Linearni zagon
D. Temperatura
E. Pomladna konstanta
Odgovor: B
Diskusija:
Je znan: V.p = k
Na vprašanje: k = …?
Odgovor:
str. V = k
k = p. V = (m³)
k = Nm = Joule
Joule je enota dela. Torej, k ima dimenzijo napora.
4. Kaj od naštetega ni pogoj za pojav Boyleovega zakona, je ...
Preberite tudi:Kloniranje je: opredelitev, vrste, prednosti in primeri
A. Fiksna temperatura
B. Fiksna prostornina in tlak
C. Kemična reakcija ne pride
D. Plin v zaprtem prostoru
E. Stanje plina se ne spremeni
Odgovor: B
Diskusija:
Boyleov zakon velja le pod določenimi pogoji, kot so konstantna temperatura plina, plin v zaprtem prostoru, brez kemične reakcije in brez sprememb v plinastem stanju.
5. V zaprti posodi je plin, ki se razširi, tako da se njegova prostornina spremeni na dvakratnik začetne prostornine (V = začetna prostornina, P = začetni tlak). Tlak plina se spremeni v ...
Diskusija
Je znan :
Začetni pritisk (P1) = P
Začetna glasnost (V1) = V
Končni obseg (V2) = 2V
Zaželeno: končni pritisk (P2)
Odgovor:
P1 V1 = P2 V2
P V = P2 (2 V)
P = P2 (2)
P2 = P / 2 = P
Tlak plina se spremeni na začetni tlak.
6. V zaprti posodi je plin, ki ima tlak 2 atm in prostornino 1 liter. Če se tlak plina spremeni na 4 atm, prostornina plina postane ...
Diskusija
Je znan :
Začetni pritisk (P1) = 2 atm = 2 x 105 paskalov
Končni tlak (P2) = 4 atm = 4 x 105 paskalov
Začetna glasnost (V1) = 1 liter = 1 dm3 = 1 x 10-3 m3
Iskan: Končni obseg (V2)
Odgovor:
P1 V1 = P2 V2
(2 x 105) (1 x 10-3) = (4 x 105) V2
(1) (1 x 10-3) = (2) V2
1 x 10-3 = (2) V2
V2 = x 10-3
V2 = 0,5 x 10-3 m3 = 0,5 dm3 = 0,5 litra
7. Zaprti prostor vsebuje plin s prostornino 200 ml. Kaj pa, če je tlak v sobi 60 cmHg, torej izračunajte tlak plina v prostoru, katerega prostornina je 150 ml?
Rešitev:
Je znan:
V1 = 200 ml
V2 = 150 ml
P1 = 60 cmHg
Na vprašanje: P2 =…?
Odgovor:
P1. V1 = P2. V2
60 cmHg. 20 ml = P2. 15 ml
P2 = 1200 cmHg / 15
P2 = 80 cmHg
Tako je bilo pojasnjeno Boyleov zakon: opredelitev, formule, aplikacije in primeri problemov, upam, da lahko dodate vaš vpogled in znanje. Hvala za obisk in ne pozabite prebrati drugih člankov.
