Kemijsko ravnovesje: opredelitev, zakoni, formule, primeri problemov
Kemijsko ravnovesje: opredelitev, zakoni, formule, primeri problemov - V tej razpravi bomo razložili kemijsko ravnovesje, zakon formule in je opremljen s popolnim in lahkim primerom kemijskega ravnovesja. Za več podrobnosti natančno preberite spodnja mnenja.
Kazalo
-
Kemijsko ravnovesje: opredelitev, zakoni, formule, primeri problemov
- Razumevanje kemijskega ravnovesja
-
Značilnosti ravnotežnega stanja
- Premik kemičnega ravnovesja
- Vpliv koncentracije snovi na kemijsko ravnovesje
- Vpliv tlaka in prostornine na kemijsko ravnovesje
- Vpliv temperature na kemijsko ravnovesje
- Zakon kemijskega ravnovesja
-
Splošna formula za kemijsko ravnovesje
- Heterogeno ravnovesje
- Homogeno ravnovesje
- Primeri težav s kemijskim ravnovesjem
- Konstanta delnega ravnovesja
- Razmerje ravnotežja delnega tlaka z ravnotežno konstanto
- Deliti to:
- Sorodne objave:
Kemijsko ravnovesje: opredelitev, zakoni, formule, primeri problemov
Najprej se natančno pogovorimo o pomenu kemijskega ravnovesja.
Razumevanje kemijskega ravnovesja
Kemijsko ravnovesje je reverzibilna reakcija, pri kateri so hitrosti reaktantov in produktov enake in njihove koncentracije so konstantne. Kemijsko ravnovesje nastopi le pri reverzibilni reakciji, pri kateri je hitrost tvorbe reaktantov enaka hitrosti tvorbe produktov.
Kemijsko ravnovesje je dinamično, zato ga pogosto imenujemo dinamično ravnovesje. Dinamično ravnovesje je izmenična reakcija, kadar so pogoji koncentracije konstantni, vendar se reakcija dejansko dogaja neprekinjeno. Dinamično ravnovesje se ne pojavi makroskopsko, temveč se pojavi mikroskopsko (delci snovi).
Kemijsko ravnotežje nastopi le pri reverzibilni reakciji, pri kateri je hitrost tvorbe reaktantov enaka hitrosti tvorbe produktov. Reakcija bo potekala neprekinjeno mikroskopsko, zato jo lahko imenujemo dinamično ravnovesje.
Značilnosti ravnotežnega stanja
Značilnosti stanja ravnovesja so naslednje:
- Pojavi se v zaprti posodi, pri stalni temperaturi in tlaku
- Hitrost reakcije na reaktante je enaka hitrosti reakcije na produkte
- Reakcija poteka neprekinjeno (dinamično) v dveh nasprotnih smereh
- Zelo mikroskopski pojav na ravni delcev snovi partikel
- Koncentracija izdelkov in reaktantov ostaja nespremenjena
Premik kemičnega ravnovesja
Obstaja več dejavnikov, ki vplivajo na kemično ravnovesje, vključno s koncentracijo snovi, temperaturo in tlakom ali prostornino.
Vpliv koncentracije snovi na kemijsko ravnovesje
Če se koncentracija ene snovi poveča, se bo reakcijsko ravnovesje premaknilo proti snovi, katere koncentracija se doda. Če se koncentracija ene snovi zmanjša, se bo ravnotežje premaknilo v smeri zmanjšane koncentracije snovi.
Primer: V naslednji reakcijski enačbi
N2 (g) + 3H2 (g) <==> 2NH3 (g) H = -92 kJ.
Če se koncentracija N2 poveča, se ravnotežna reakcija premakne v desno, kajti če se poveča koncentracija snovi, se ravnotežna reakcija premakne iz smeri dodane koncentracije.
Če se koncentracija N2 zmanjša, se ravnotežna reakcija premakne v levo, kajti če se koncentracija snovi zmanjša, se ravnotežna reakcija premakne iz smeri zmanjšane koncentracije.
Preberite tudi:Razumevanje analitične kemije, vrst in metod (popolno)
Vpliv tlaka in prostornine na kemijsko ravnovesje
Če se tlak v sistemu poveča ali prostornina zmanjša, se bo reakcijsko ravnotežje premaknilo proti manjšemu številu molekul.
Če se tlak v sistemu zmanjša ali prostornina poveča, se bo ravnotežje premaknilo proti manjšemu številu molekul.
"tlak in prostornina sta obratno povezana"
Primer: V naslednji reakcijski enačbi
N2 (g) + 3H2 (g) <==> 2NH3 (g) H = -92 kJ
Število molov reaktantov = 1 + 3 = 4
Število molov izdelka = 2
Če se tlak v sistemu poveča, se ravnotežna reakcija premakne v desno, ker če Ko se tlak poveča, se bo reakcijsko ravnovesje premaknilo v smeri najmanjšega števila molekul tj. 2.
Če se prostornina v sistemu zmanjša, se bo ravnotežje premaknilo v desno, ker če Če se prostornina sistema zmanjša, se bo reakcijsko ravnotežje premaknilo v smeri manjših molekul tj. 2.
Če se tlak v sistemu zmanjša, se ravnotežna reakcija premakne v levo, ker če se tlak poveča. Torej se bo ravnotežna reakcija premaknila proti večjemu številu molekul, to je 4.
Če se tlak v sistemu poveča, se reakcijsko ravnovesje premakne v levo, ker če se poveča prostornina sistema. Torej se bo reakcijsko ravnotežje premaknilo v smeri večjega števila molekul, to je 4.
Vpliv temperature na kemijsko ravnovesje
Ko se temperatura sistema poviša, se ravnotežna reakcija premakne v smeri snovi, ki sprošča toploto ali trdnost.
Če se temperatura sistema zmanjša, se ravnotežna reakcija premakne v smeri snovi, ki sprošča toploto ali je eksotermna.
Primer: V reakcijski enačbi
[A] + [B] <==> [C] H = -X
[C] je eksotermna reakcija (sproščanje toplote in [A] + [B] je endotermna reakcija (zahteva toploto)
Če se temperatura poveča, se bo ravnotežna reakcija premaknila v levo, ker če temperatura Če sistem povečamo, se bo ravnotežna reakcija premaknila v smer reakcije, ki zahteva toploto oz endotermni.
Če se temperatura zniža, se bo ravnotežna reakcija premaknila v desno, ker če temperatura Če sistem dvignemo, se bo ravnotežna reakcija premaknila v smer reakcije, ki zahteva toploto oz endotermni.
Če se temperatura zniža, se bo ravnotežna reakcija premaknila v desno, ker če Če se temperatura sistema poveča, se bo reakcijsko ravnovesje premaknilo v smer, ki sprošča toploto eksotermni.
Zakon kemijskega ravnovesja
Zakon kemijskega ravnovesja ali ravnotežne konstante je razmerje med koncentracijami produkta in močjo koeficientov vsake koncentracije reaktata do moči njihovih koeficientov. Konstanto ravnotežja lahko simboliziramo s K ali Kc.
Preberite tudi:Dodatki * f: Definicija, narava, vrste in vplivi
Splošna formula za kemijsko ravnovesje
Enačba ali formula kemijskega ravnovesja je naslednja: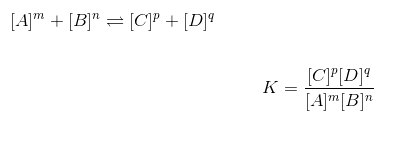
Heterogeno ravnovesje
Oblike snovi, ki sodelujejo v reakcijah v tem heterogenem ravnotežju, so različne, zato je to sprejeto določitev ravnotežne konstante je koncentracija snovi, na katero vpliva ravnotežna konstanta, raztopina in plini.
Homogeno ravnovesje
V tem homogenem ravnovesju so oblike snovi, ki sodelujejo v reakciji, enake, zato so vse koncentracije snovi, uporabljene za določitev ravnotežne konstante. Vendar ne smemo pozabiti, da je vpliv na ravnotežno konstanto le v obliki plinov in raztopin.
Primeri težav s kemijskim ravnovesjem
Glede na ravnotežno reakcijo
2A + B <==> A2B
Sprva sta v 2-litrski posodi 2 mola A in 2 mola B, če je v ravnovesju 0,5 mola A, kolikšna je ravnotežna konstanta?
Odgovor:
Na podlagi zgornje trditve lahko število molov določimo na naslednji način: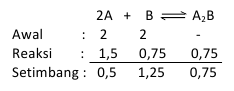
Nato: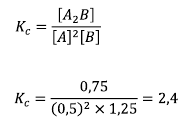
Obseg problema je vpliven, ker bo odpravil drug drugega.
Konstanta delnega ravnovesja
Konstanta parcialnega ravnovesja je razmerje med produktom delnih tlakov izdelkov in močjo njihovih koeficientov z delnimi tlaki reaktantov do moči njihovih koeficientov. Delno konstanto ravnovesja lahko simbolizira Kp.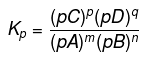
Informacije
P = delni tlak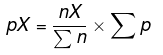
Informacije:
pX = parcialni tlak za iskanje
nX = moli snovi, katere delni tlak najdemo
En = skupni moli sistema
Ep = skupni delni tlak sistema
Primer težav:
Skupaj se 6 molov NH3 segreje, da nastane N2 in H2. Ko je ravnotežje doseženo, ostaneta 2 mola NH3, če je skupni tlak mešanice plinov 10 atm, določite vrednost Kp !.
Odgovor:
Iz zgornjega vprašanja lahko dobimo naslednje podatke: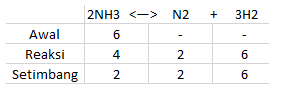
Skupno molov v sistemu: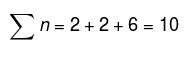
Poiščite parcialni tlak vsake snovi z enačbo: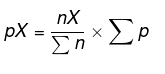
Tako dobimo pBH3 = 2 atm, pN2 = 2 atm in pH2 = 6atm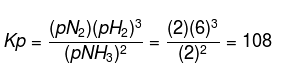

Razmerje ravnotežja delnega tlaka z ravnotežno konstanto
To razmerje lahko izrazimo v naslednji enačbi: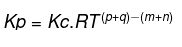
Informacije:
R = plinska konstanta
T = temperatura
p, q, m in n = koeficienti reagirajočih snovi
Stopnja disociacije
Stopnja disociacije je vrednost, ki se uporablja za določanje, koliko delov snovi je ločenih. Enačba za stopnjo disociacije je: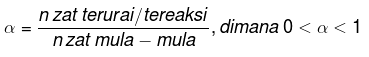
Pomen ravnotežne konstante
Konstanto ravnotežja lahko uporabimo za več funkcij, vključno z:
- Daje namige o položaju ravnotežja
- Ocenjevanje smeri reakcije
Tako je bilo pojasnjeno Kemijsko ravnovesje: opredelitev, zakoni, formule, primeri problemov, upam, da lahko dodate vaš vpogled in znanje. Hvala za obisk in ne pozabite prebrati drugih člankov.
