Opredelitev adsorpcije, vrste, dejavniki, dejstva, razlike in primeri

Opredelitev adsorpcije
Dogodek ali pojav te adsorpcije je dogodek, v katerem snov pritegne druge snovi v bližini, da medsebojno vplivajo in se nanjo vežejo. Ta postopek adsorpcije se lahko ali lahko zgodi med snovmi, ki so v eni fazi, na primer trdna in trdna snov, ali snovmi v različnih fazah, kot sta trdna in tekoča.
Medtem je nasprotje adsorpcije, in sicer desorpcija, postopek sproščanja enega materiala iz drugega materiala.
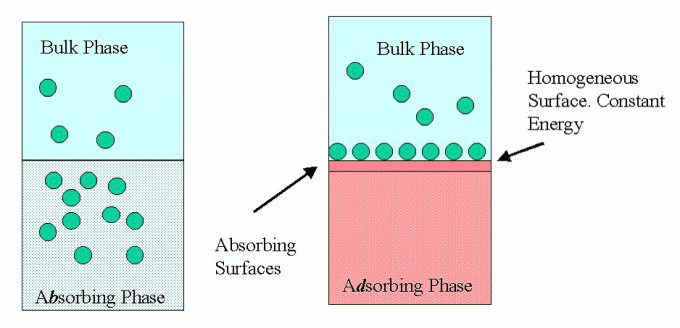
Obstoj tega adsorpcijskega dogodka bo povzročil, da se snovi, ki se sprva širijo v okolje, zbirajo in vežejo na 1 imenovani adsorpcijski medij in sicer kot adsorbent, kjer ima ta adsorbent sposobnost, da pritegne druge primerne snovi za interakcijo z materialom to. Medtem ko se druge snovi, ki jih privlači ali so prav tako vezane na adsorbcijski material, imenujejo adsorbati.
Pojav adsorpcije vključuje interakcije med površinami na molekuli, kjer ima adsorbcijski material to površino s težnjo k privabljanju drugih materialov, tako da se adsorbirani material, ki je bil ali je bil vezan, drži na površini adsorbent.
Ta postopek adsorpcije se pogosto uporablja na kemičnem področju, kot je katalizator, čistilec vode in zmanjšuje onesnaževanje vode.
Ko govorimo o adsorpciji, poznamo tudi izraz absorpcija. V bistvu sta si ta dva dogodka ali dogodka podobna, le da adsorpcija vključuje vezavo molekul na zgornjo plast adsorbenskega materiala. Medtem ko je pri absorpciji vezava ali pritrditev molekul ponavadi globlji, tako da prodrejo skozi plast adsorbcijskega materiala. Zato ima na splošno absorpcijski dogodek večjo trdnost vezi.
Načelo adsorpcije
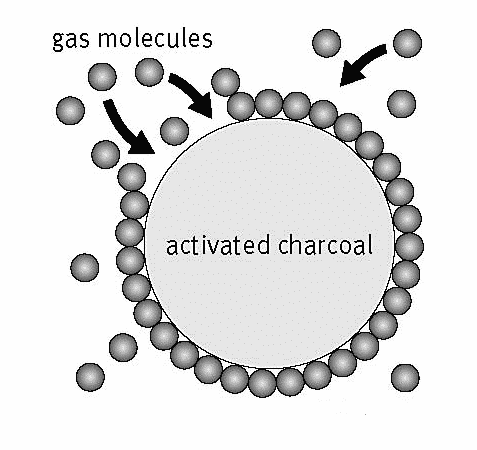
Ta adsorpcija nastane zaradi nestabilnosti ali tudi v znanstvenem jeziku, imenovanem preostale sile na površini adsorbent, zaradi česar je zaradi stabilnosti nagnjen k povezovanju z drugimi primernimi snovmi stabilnost.
Zato imajo adsorbentni materiali na splošno tako imenovane skupine z velikim aktivnim mestom ki ima ta skupina pomembno vlogo v procesu adsorpcije, in sicer pri interakciji z molekulami adsorbirajo. Poleg te interakcije lahko adsorpcijo povzroči tudi prisotnost votlin ali por v adsorbentu.
Materiali, kot sta aktivno oglje in zeolit, so porozni materiali, ki imajo v sebi veliko površino. Posledično lahko adsorbat vstopi v pore in zapolni obstoječo votlino, tako da bo ujet v pore.
Poleg tega se material, ki je bil ali je že v adsorbentu, lahko ali lahko stabilizira na kakršen koli način vrste interakcij, kot so vodikove vezi, elektrostatične interakcije, dipolne interakcije, van der Waalsove interakcije in druge itd.
Vrsta adsorpcije

Različne vrste adsorpcije in ta pojasnila vključujejo naslednje;
Physisorption (fizična adsorpcija)
Fizorpcija je ena vrsta adsorpcije, ki temelji na interakciji med adsorbatom in adsorbentom. Pri fizični adsorpciji bo adsorbent privlačil adsorbat in oba bosta imela fizične interakcije, kot je privlačna sila zaradi van der Waalsovih interakcij.
Vendar ta fizizorpcija ne vključuje vezi med molekulo adsorbenta in adsorbatom. Rezultat tega je, da zaradi odsotnosti vezi med njima pride do interakcije adsorbenta in Tudi adsorbat je ponavadi šibek in tovrstna adsorpcija je ponavadi lažja desorpcija.
Kemisorpcija / Kemisorpcija (kemijska adsorpcija)
Kemisorpcija je druga vrsta adsorpcije, ki je adsorpcija s kemično interakcijo. Pri kemisorpciji se molekule adsorbenta in adsorbata kemično vežejo. Prisotnost kemičnih vezi med adsorbentom in adsorbatom bo okrepila interakcijo med obema materialoma.
Posledično je odstranjevanje molekul adsorbata iz adsorbenskega materiala težje in zahteva več energije kot fiziorpcija. Zato se ta vrsta kemisorpcije pogosto uporablja za nekatere namene zaradi narave vezi, ki je navadno močna.
Razlika med fizikalno in kemijsko adsorpcijo
Razlike med fizikalno in kemijsko adsorpcijo (Atkin, 1999: 437-438) so razvidne iz tabele, vključno z naslednjim:
Fizična adsorpcija |
Kemična adsorpcija |
| Molekule so na adsorbent vezane z Van der Wallsovimi silami | Te molekule so na adsorbent vezane s kemičnimi vezmi ikatan |
| Ima reakcijsko entalpijo -4, ki znaša -40 kJ / mol | Ima reakcijsko entalpijo od -40 do 800kJ / mol |
| Lahko tvori večplastne plasti | Oblikovanje enoplastnega lapisana |
| Ta adsorpcija se zgodi samo pri temperaturah pod vreliščem adsorbata | Ta adsorpcija se lahko ali lahko pojavi pri visokih temperaturah |
| Količina adsorpcije na površini je odvisna od adsorbata | Količina adsorpcije na površini je značilnost adsorbenta in adsorbata |
| Ne vključuje posebne aktivacijske energije | Vključuje določeno aktivacijsko energijo |
| Ni specifično | Je zelo specifičen |
Dejavniki, ki vplivajo na adsorpcijo
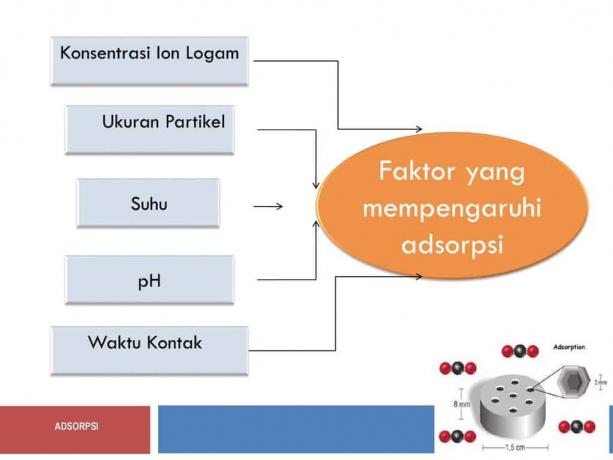
Dejavniki, ki so lahko ali lahko gonilna sila te adsorpcije, so med drugim naslednji;
Aktivacija adsorbenta
Preden lahko material uporabimo kot adsorbent, ga moramo obdelati, kar imenujemo aktivacija. Cilj tega postopka aktivacije je, da adsorbcijski material absorbira ali absorbira druge snovi.
Aktiviranje se običajno izvede tako, da se gost, ki je prisoten v porah ali adsorbentni votlini, odstrani tako adsorbentni material dobimo s prazno votlino in ga je mogoče tudi napolniti z adsorbatom, ki želeno.
Ta postopek aktivacije je mogoče ali je mogoče izvesti na vse načine, na primer s segrevanjem uparjanje snovi za goste ali tudi z močno kislinsko pranje, da se material gosta raztopi adsorbent.
Površina adsorbenta
Površina ali površina ima tudi pomembno vlogo v procesu adsorpcije, ker ta dogodek vključuje površino adsorbenta. Večja kot je površina adsorbenta, ima material tudi večjo adsorpcijsko sposobnost.
To je zato, ker večja površina kaže, da ima material več možnosti za interakcijo z adsorbatom.
Čas za stik
V bistvu, dlje kot mešamo adsorbent z adsorbatom, večja bo interakcija. To je zato, ker mora v adsorpcijskem postopku adsorbat včasih iti skozi difuzijo, za kar je potreben tudi čas.
Zato bo z dovolj časa popoln postopek difuzije nato povečal adsorpcijsko sposobnost snovi.
Vpliv temperature
Ta temperatura okolice vpliva tudi na postopek adsorpcije, ker v osnovi ta adsorpcija v ravnovesju sledi načelu Le-Chatelierja kjer je višja temperatura, se bo proces adsorpcije zmanjšal, medtem ko se pri nizkih temperaturah ta reakcija nagiba k prav.
Učinek tlaka
Učinek tega tlaka se običajno pojavi pri adsorpciji molekul plina, kjer je povišanje tlaka adsorbata v tem primeru plin, poveča se adsorpcijska sposobnost adsorbenta.
To je zato, ker je pri visokih tlakih molekula običajno prisiljena zasesti ozek prostor, ki Zgodilo se bo, da bodo molekule ob pritisku lažje vstopile v votlino ali tudi v pore adsorbenta visoko.
Dejstva o postopku adsorpcije
Vsa vrsta dejstev, ki so med drugim značilna za adsorpcijo v tej kemiji, so naslednja;
Adsorpcija se pojavi spontano
Kot vemo, da kadar se dogodek zgodi spontano, to pomeni ta dogodek lahko ali se lahko zgodi, ne da bi potrebovali določeno energijo, in se lahko ali lahko pojavi z sama. Ta spontana reakcija kaže, da ima reakcija negativno Gibsovo energijsko vrednost.
Pri adsorpciji ta spontani postopek pokaže, da lahko ta adsorbirajoči material absorbira adsorbat brez kakršne koli druge energetske pomoči.
Adsorpcija je eksotermni proces
Poleg tega, da se ta proces adsorpcije pojavi spontano, naj bi bil tudi eksotermni proces. Kar zadeva termokemijo, je bilo ali je bilo preučeno, da eksotermni proces kaže, da reakcija poteka skupaj s sproščanjem energije in v procesu proizvaja toploto.
Tudi adsorpcijski dogodek je enak, ko adsorbent absorbira adsorbat in tvori tudi interakcijo med teh dveh molekul bo prišlo do določene količine sproščanja energije in dobimo višjo temperaturo kot okolje.
Primer aplikacije adsorpcije
Primeri uporabe te adsorpcije so med drugim naslednji;
Absorber strupov iz Norita
Norite je material, sestavljen iz aktivnega oglja. Kot vemo, je aktivno oglje porozen material, ki ima zelo dobro adsorpcijsko sposobnost. Ta norit se uporablja kot adsorbent za absorpcijo ali tudi za absorpcijo toksinov, plinov in snovi, ki v želodcu niso potrebni in se nato odstranijo.
Čistilec vode iz Tawasa
Alum je aluminijev sulfat, ki ima tudi visoko adsorpcijsko sposobnost. Ta alum material se pogosto uporablja kot čistilec vode, ki je v vodi tega materiala ima sposobnost absorpcije drugih snovi, kot so barvila, nečistoče in drugi onesnaževalci v vode.
Odstranjevalec težkih kovin
Ta adsorpcija je bila razvita tudi za premagovanje problema onesnaženja industrijske odpadne vode, ki vsebuje težke kovine in je lahko nevarna pri onesnaževanju okolja. Inovacija je, da težke kovine v vodi adsorbirajo z učinkovitim adsorbentom.
Tako je razlaga definicije adsorpcije, vrst, dejavnikov, dejstev, razlik in primerov, upam, da je opisano lahko koristno za vas. Hvala vam
Poglej tudiOpredelitev protonov
Poglej tudiOpredelitev prehrane
Poglej tudiOpredelitev nebančnih finančnih institucij, funkcij in ciljev
