Opredelitev termodinamike, principi, koncepti, formule, zakoni, primeri

Opredelitev termodinamike
Ta definicija termodinamike je znanost, ki opisuje / ponazarja prizadevanja za spreminjanje toplote (tj prenos energije zaradi temperaturne razlike) v energijo in tudi lastnosti njegovi zagovorniki. Termodinamika je tesno povezana s fiziko energije, dela, toplote, entropije in tudi spontanostjo procesov.
Poleg tega je termodinamika povezana tudi s statično mehaniko. Ta veja fizike nato proučuje izmenjavo energije v obliki toplote in dela, omejevanje sistemov in okolja. Nato se lahko uporaba in uporaba te termodinamike pojavi v človeškem telesu, na primer v primeru ali pojavu pihanja vroče kave, Hladilniki, elektronska oprema, avtomobili, elektrarne in industrija so najpogostejši termodinamični dogodki, s katerimi se srečuje življenje vsak dan.
Načela termodinamike
Za uporabo načel termodinamike, ki vključujejo mehaniko, toploto in diferenčni račun v drugih znanostih, je prikazano na tej sliki.
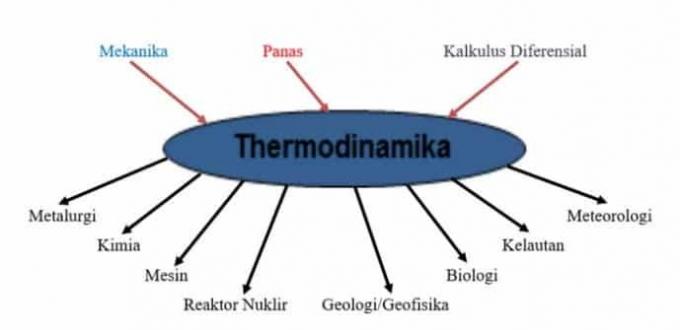
Naslednja slika prikazuje, da se rešitev problema / problema s termodinamiko izvaja v več fazah, vključno z:
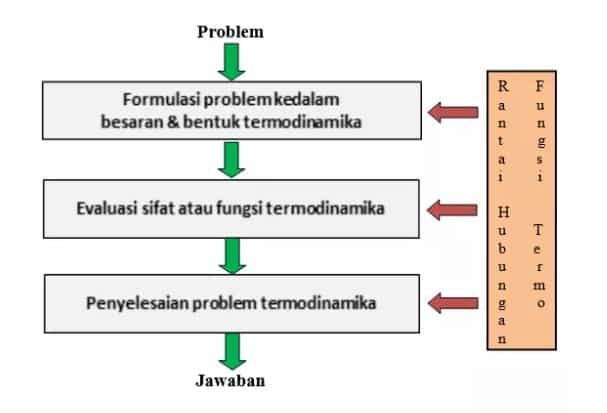
Oblikovanje problema v termodinamične količine in oblike. To potem rečemo tako, da jezik v problemu spremenimo v jezik termodinamike, nato pa ga formuliramo z uporabo termodinamičnih količin.
Vrednotenje termodinamičnih lastnosti in funkcij pomeni izvedbo analize formulacije, ki je bila pripravljena ali je bila pripravljena v prvem koraku (1). Ta stopnja nato zahteva ustrezno razumevanje termodinamičnega znanja, tako da ni napačnega dojemanja smeri ali namena problema.
Reševanje termodinamičnih problemov. Na tej stopnji je potrebna podpora matematičnemu / računskemu znanju (diferencialno, integralno), da lahko dobimo veljavne ali odgovorne odgovore.
Ti trije koraki reševanja termodinamike morajo nato temeljiti na postulatih ali tudi pravilih v termodinamiki.
V bistvu je to načelo termodinamike pravzaprav naravna stvar, ki se dogaja v vsakdanjem življenju. Z razvojem znanosti in tehnologije je nato termodinamika zasnovana na tak način tako, da potem postane oblika mehanizma, ki lahko ali lahko pomaga ljudem njegove dejavnosti. Tako široka uporaba termodinamike je bila omogočena zaradi razvoja znanosti o termodinamiki od 17. stoletja. Nato se razvoj znanosti o termodinamiki začne z makroskopskim pristopom, in sicer s splošnim vedenjem delcev snovi, ki nato postanejo nosilci energije.
Termodinamični postopek
Termodinamični postopek je razdeljen na štiri vrste, odvisno od stanja tlaka, prostornine in temperature v času, ko se postopek zgodi. Ta postopek je običajno prikazan v diagramu P-V, ki je diagram, ki opisuje tlak (P) in prostornino (V), ko pride do procesa. Pri vseh vrstah termodinamičnih procesov si je treba zapomniti dve pomembni stvari, in sicer spremenljivke, ki se spreminjajo, in opravljeno delo. Delo, ki se zgodi v termodinamičnem procesu, je mogoče ali pa je mogoče poznati z izračunom površine grafa P-V.
Izobarski proces
Ta izobarni je termodinamični proces, ki ne spremeni vrednosti tlaka v sistemu 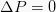
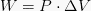
Iz te formule je tudi znano, da če se glasnost poveča (pride do razširitve), potem potem je posel pozitiven in tudi če se obseg zmanjša (pride do amortizacije), je posel vreden negativno.

Izohorski proces
Ta izohorni je termodinamični proces, ki ne spremeni vrednosti prostornine sistema 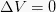

Izotermični proces
Ta izoterma je termodinamični proces, ki ne spremeni temperaturne vrednosti sistema 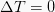
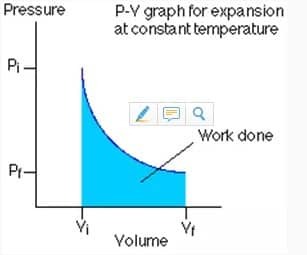
Vrednost izotermično obdelanega dela je izražena z naslednjo enačbo:
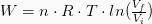
Kjer je n količina snovi, izražena v molih, je R plinska konstanta, za T pa temperatura. Formulo dobimo s kombiniranjem delovne enačbe na diagramu P-V z enačbo idealnega plina.
Adibatski proces
Adiabatski je termodinamični proces, ki ne spremeni kalorične vrednosti sistema (Q = 0).

V monatomskem plinu lahko delo, opravljeno v adiabatskem procesu, izrazimo z enačbo:
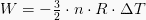
Na prvi pogled imajo ti adiabatski in izotermični procesi podobne diagrame P-V. Podrobneje je razvidno, da ima adiabatski postopek bolj strm naklon kot izotermični postopek, kot je prikazano v naslednjem grafičnem primeru.

Če je celoten postopek opisan kot diagram P-V, lahko dobimo naslednji graf. Ne smemo pozabiti, da so enote, uporabljene pri izračunih, mednarodne enote. Na primer, uporabljena enota za temperaturo je Kelvin, enota za prostornino pa je m3, enota za količino snovi pa so moli.
Termodinamični sistem
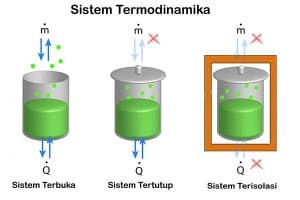
Ta termodinamični sistem je del vesolja, ki šteje. Resnična ali namišljena meja ločuje sistem od vesolja, ki se imenuje okolje. Klasifikacija termodinamičnih sistemov glede na naravo meje sistem-okolje in prenos snovi, toplote in entropije med sistemom in okolico.
Obstajajo tri vrste sistemov, ki temeljijo na vrsti izmenjave med sistemom in okoljem:
Zaprti sistem
Obstaja izmenjava energije (toplote in dela), izmenjave predmetov z okoljem pa ni. Rastlinjak je primer zaprtega sistema, v katerem pride do izmenjave toplote, vendar ni izmenjave dela z okoljem. Ali sistem izmenjuje toploto, delo ali oboje, se običajno šteje za njegovo omejujočo lastnost:
- Adiabatska pregrada: ne dovoljuje izmenjave toplote
- Trda pregrada: ne dovoljuje izmenjave delovnih mest.
Izoliran sistem
Z okoljem ni izmenjave toplote, snovi ali dela. Primer tega izoliranega sistema je izolirana posoda, na primer v izolirani plinski jeklenki.
Odprti sistem
Obstaja izmenjava energije (toplote in dela) in predmetov z njihovim okoljem. Pregrada, ki nato omogoča izmenjavo predmetov, se imenuje prepustna. Ta ocean je primer odprtega sistema.
V resnici sistem ne more ali ga je mogoče popolnoma izolirati od okolja ker mora biti nekaj mešanja, četudi gre le za rahel umik gravitacija. Pri analizi izoliranega sistema je energija, ki vstopa v sistem, enaka energiji, ki zapusti sistem.
Termodinamično stanje
Ko je sistem v danem stanju v stanju ravnotežja, se imenuje določeno stanje (ali tudi stanje sistema).
Za dano termodinamično stanje ali situacijo so določene številne lastnosti sistema. Lastnost, ki je neodvisna od poti, po kateri sistem oblikuje stanje, se imenuje državna funkcija sistema. Naslednji odsek tega oddelka nato obravnava samo lastnosti, ki so državne funkcije.
Število minimalnih lastnosti, ki jih je treba določiti za opis stanja ali stanja določenega sistema, določa Gibbsov fazni zakon. Običajno se bo ta oseba soočila s sistemsko lastnostjo, ki je večja od te minimalne količine.
Možen je razvoj odnosov med lastnostmi različnih okoliščin. Ta enačba stanja je primer takega razmerja.
Temeljni zakoni termodinamike

V termodinamičnem sistemu veljajo 4 osnovni zakoni, med katerimi so:
Ničelni zakon termodinamike
Začetni zakon določa, da sta dva sistema v ravnovesju, torej s tretjim sistemom, potem so vsi trije med seboj v ravnovesju. Zakon se vnese po prvem zakonu.
Prvi zakon termodinamike
Isti zakon velja za primer ohranjanja energije. Nato zakon navaja spremembo notranje energije zaprtega termodinamičnega sistema, je enako s skupno količino dovedene toplotne energije v sistem in opravljenim delom na sistemu sistem. Zakon se lahko ali lahko razdeli na več procesov, vključno z procesi z izotermičnimi, izohornimi, izobarnimi in tudi adiabatskimi.
Drugi zakon termodinamike
Drugi zakon termodinamike obravnava entropijo. Za drugi zakon termodinamike ni zvoka, obstaja le ena izjava o eksperimentalnem dejstvu Kelvin-Plank in Clausius ali o njem.
- Clausiusova izjava je, da je nemogoče, da bi kateri koli sistem deloval tako, da bi bil edini rezultat: je prenos energije kot toplote iz sistema z določeno temperaturo v sistem z višjo temperaturo visoko.
- Izjava Kelvin-Planck pravi, da sistem nemogoče potem delovati v ciklu termodinamike in zagotavlja nekaj neto dela okoli nje, medtem ko prejme toplotno energijo 1 toplotni rezervoar. (v Osnove inženirske termodinamike (Moran J., Shapiro N.M. - 6. izd. - 2007 – Wiley) 5. poglavje).
Skupna entropija izoliranega termodinamičnega sistema sčasoma narašča, nato pa se približuje največja vrednost se imenuje tudi načelo naraščajoče entropije ", to je korelacija zgornjih izjav II (analiza drugega termodinamika za postopek je uporaba ali uporaba lastnosti entropije) (vir Osnove inženirske termodinamike (Moran J., Shapiro N.M. - 6. izd. - 2007 - Wiley)) Poglavje6).
Tretji zakon termodinamike
Tretji zakon termodinamike obravnava absolutno ničelno temperaturo. Ta zakon nato določa, da ko sistem potem doseže temperaturo nič absolutne vrednosti, se bo celoten postopek ustavil in entropija sistema se bo približala vrednosti najmanj Zakon tudi določa, da je entropija telesa s popolno kristalno strukturo pri temperaturi absolutne ničle enaka nič.
Primeri problemov s termodinamiko
Plin z začetno prostornino 10 m3 se segreva v izobarnih pogojih, dokler končna prostornina ne doseže 25 m3. Če je tlak plina 2 atm, določite zunanje delo plina! (1 atm = 1,01 x 105 Pa).
Odgovor:
Ugotovil, da:
V2 = 25 m3
V1 = 10 m3
P = 2 atm = 2,02 × 105 Pa
Vprašanje je W?
Izobare → Fiksni tlak, uporabite formulo W = P (ΔV)
W = P (V2 V1)
Š = 2,02x 05 x (25 10) = 3,03 × 106 džuljev
Tako je razlaga definicije termodinamike, načel, konceptov, formul, zakonov in primerov, upam, da je opisano lahko koristno za vas. Hvala vam
Poglej tudiRazumevanje zapovednih, izjavnih, vprašalnih stavkov, značilnosti in primerov
Poglej tudiOpredelitev norm, funkcij, značilnosti, vrst in primerov
Poglej tudiDefinicija hemoglobina (Hb), funkcija, vzrok in struktura
