Definicija benzena, lastnosti, struktura, derivati in razvrstitev
Opredelitev benzena
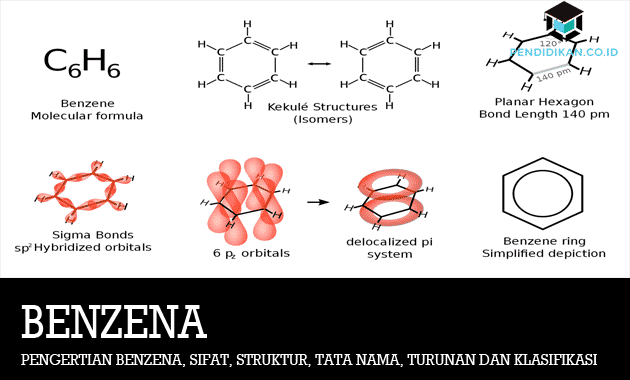
Benzen je naftni proizvod, prvotno izdelan iz premogovega katrana, ki se uporablja kot sestavni del vseh vrst potrošniških in industrijskih izdelkov. Benzen je odkril Faradatov človek, nato pa je Mitscherlich molekularno formulo pozneje določil kot C6H6. Benzen je vključen tudi v razred ogljikovodikovih spojin. Benzen ima visoko stopnjo nasičenosti.
Benzenske spojine in tudi številni njihovi derivati se nato razvrstijo v aromatske spojine, ki ki temelji na aromi, ki jo imajo nekatere od teh spojin. Vendar kemiki zdaj teh kemičnih spojin ne razvrščajo več po temelji le na njegovih fizikalnih lastnostih, ampak na podlagi strukture in njegova reaktivnost.
Lastnosti benzena
Na splošno lahko lastnosti teh spojin združimo v dve, in sicer fizikalne in kemijske lastnosti.
1. Fizične lastnosti
Benzen je brezbarvna, hlapljiva in zelo strupena tekočina. Ta benzen lahko ali ga lahko uporabimo kot topilo, sintetizator vseh vrst ogljikovih spojin in osnovni material za izdelavo ogljikovih spojin. Benzen zaradi zelo visoke vsebnosti ogljika ni zelo reaktiven, a zelo vnetljiv.
Več derivatov benzena ima polarne in nepolarne lastnosti. Ta polarna spojina je spojina, ki nastane zaradi prisotnosti vezi med elektroni v vsakem elementu. Vrelišče benzena in njegovih derivatov se začne pri 80-250 stopinjah Celzija. Tudi tališče se spreminja, najvišje število pa je 122 stopinj Celzija v spojini benzojske kisline (-COOH).
Razlike v vrelišču povzroča vpliv polarnosti funkcionalnih skupin. Prisotnost nadomestka vpliva tudi na tališče. Tako kot benzen imata toluen in etil benzen nepolarne lastnosti. Medtem ko imajo anilin, benzil alkohol, fenol in benzojska kislina polarne lastnosti. Tako lahko sklepamo, da ima benzojska kislina najvišjo temperaturo vrelišča zaradi bolj polarne narave, medtem ko ima benzen najnižje vrelišče.
Spojine derivata benzena, ki imajo nepolarne lastnosti, se v vodi ne raztopijo, nasprotno, tiste, ki imajo polarne lastnosti, se raztopijo v vodi.
Značilnosti fizikalnih lastnosti
- Hlapna tekočina
- Brezbarven
- Diši posebno
- Tališče 5,53 ° C
- Vrelišče 80,1 ° C
- Nepolarne spojine
2. Kemijske lastnosti
Ta stopnja kislosti je ena od kemijskih lastnosti benzena in njegovih derivatov. Fenol in benzojska kislina sta šibki kislini. Benzojska kislina je močnejša od fenola. Fenoli, ki imajo funkcionalno skupino -OH, so dejansko šibke kisline, kar pomeni, da dajejo H + ione, medtem ko je za anilin, ki ima skupino -NH2, šibka baza, kar pomeni, da sprejema ione H +. Benzen je lažje podvržen substitucijskim reakcijam kot reakcijam dodajanja.
Kemijske lastnosti
- Doživeti reakcijo dodajanja ali substitucije, pri kateri je substitucija vodikovega atoma v benzenu znana kot spojina derivata benzena.
- Je manj reaktivne narave, ker konjugirana vez, ki bo doživela resonanco, lahko ali lahko povzroči, da je vez v benzenu zelo stabilna. Zato reakcija na benzen običajno zahteva katalizator za pospešitev reakcije.
- Ima kazinogene (strupene) lastnosti.
- Nepolarne spojine.
- Manj reaktiven, a tudi vnetljiv in prav tako proizvaja veliko saj.
- Nadomestne reakcije so lažje kot dodajanje.
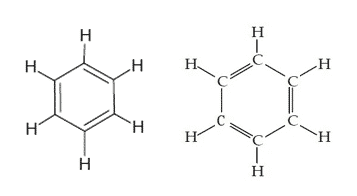
Benzenska strukturna formula
Struktura benzena je zapisana kot šestčlenski (šesterokotni) obroč, ki vsebuje izmenične enojne in dvojne vezi.
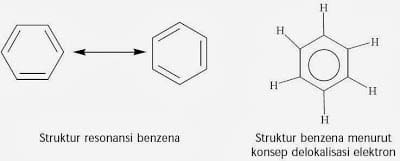
Struktura pogačic to ponazarja, da bo pri kakršni koli zamenjavi atomov broma na vodiku nastala ista spojina, ker je vseh šest atomov ogljika in vodik enakovrednih. Kekule bi lahko ali bi lahko razložil dejstvo, da če benzen reagira z bromom z uporabo FeCl3 katalizatorja ima le 1 spojina molekulsko formulo C6H5Br.
Benzenov obroč je nato predstavljen v obliki pravilnega šesterokotnika s krogom vsebovano v njem, z določbo, da je na vsakem vogalu šesterokotnika nato vezan a H-atomi.
Nomenklatura Benzen
Spodaj je navedena nomenklatura benzena, razlaga pa naslednja:
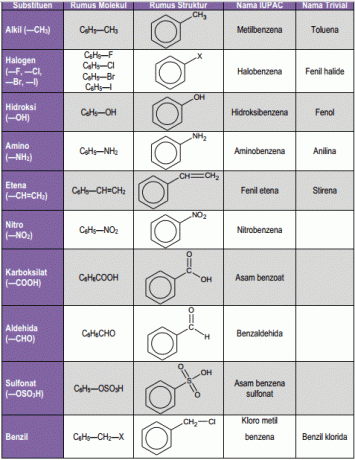
1. Monosubstitucija benzena

Benzen z enim alkilnim substituentom je imenovan kot derivat benzena, na primer etilbenzen. Sistem IUPAC še naprej uporablja splošna imena za nekatere monosubstituirane benzene, kot so toluen, kumen, stiren.
Ta običajna imena, kot so fenol, anilin, benzaldehid, benzojska kislina, anizol, se še vedno uporabljajo tudi v sistemu IUPAC. Sistem IUPAC (Mednarodna zveza čiste in uporabne kemije) je institucija, pooblaščena za oblikovanje nomenklature spojin.
2. Nadomeščen benzen
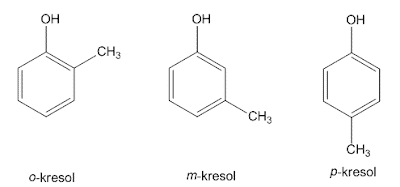
Ta nadomestek je, da benzen veže dva substituenta, zato je mogoče imeti tri strukturne izomere. Če sta oba substituenta vezana z 1,2-ogljikovimi atomi, se med seboj imenuje orto (o) 1, če je 1,3-ogljik meta (m), 1,4 pa para (p).
Ta sistem IUPAC uporablja splošno ime ksilen za 3 izomere dimetilbenzena, in sicer o-ksilen, m-ksilen in p-ksilen. Če 2 omo substituenta ne data posebnega imena, potem je vsak od substituentov dobil a Številke in imena bodo razvrščena po abecedi in končana z besedo benzen. Atom ogljika, na katerega je ta substituent pritrjen po abecedi, je oštevilčen 1.
3. Polisubstitucija benzena

Ko so na benzenski obroč pritrjeni trije ali več substituentov, je položaj vsakega od teh substituentov označen s številko. Če eden od substituentov da posebno ime, potem je navedeno ime spojine, in sicer kot izpeljanka tega posebnega imena. In če vsi substituenti ne dajo posebnega imena, bo potem njihov položaj izraženo s številkami in razvrščeno tudi po abecedi, nato pa se konča z besedo benzen.
Reakcija benzena
Pogosta reakcija je reakcija elektrofilne substitucije, obstajajo 4 vrste, med katerimi so:
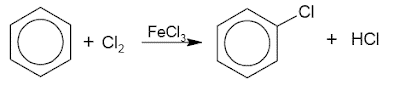
1. Nadomestitev s halogenom (halogeniranje)
Ta benzen je substituiran s halogenom z uporabo katalizatorja železovega (III) halogenida. Primeri so:
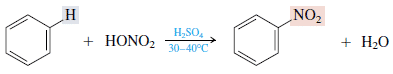
2. Nadomestitev z dušikovo kislino (nitriranje)
Ta benzen reagira s koncentrirano dušikovo kislino z uporabo koncentriranega katalizatorja žveplove kisline in tvori nitrobenzen. Primeri, kot so:
3. Nadomestitev s koncentrirano žveplovo kislino (sulfoniranje)
Do tega sulfonacije pride, ko se benzen segreje s koncentrirano žveplovo kislino. Primeri, kot so:
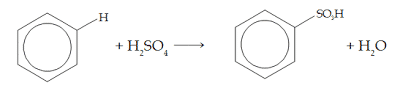
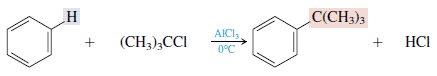
4. Nadomestitev z alkil halogenidi (alkilacija)
To reakcijo lahko uporabimo za tvorbo alkil benzena z uporabo katalizatorja iz aluminijevega klorida (AlCl3). Primeri, kot so:
Razvrstitev in uporaba benzena
Spodaj je nekaj derivatov benzena in njihova uporaba v vsakdanjem življenju.
-
Benzen
Benzen se pogosto uporablja kot topilo, osnovni material za izdelavo stiren monomer (C6H6 - CH = CH2). Ta stiren monomer je polimerni material za izdelavo sintetične gume, sestavin pesticidov, umetnih sladil. Poleg tega se benzen uporablja tudi kot najlonski osnovni material. -
Benzojska kislina (C6H5COOH)
Benzojska kislina ali njena natrijeva sol se uporablja kot konzervans za vse vrste pripravkov hrane in pijače. Ta kislina ali sol je bila izbrana, ker ne vpliva na okus konzervirane hrane. -
Fenol (C6H5OH)
Fenol lahko ali lahko uniči mikroorganizme, tako da se nato uporablja kot germicid, kot so čistila za tla (karbolna kislina). -
Salicilna kislina
Ta kislina je znana kot o-hidroksibenzojska kislina. Za to se pogosto uporablja kot antiseptik na koži, kot je kožni puder. Je tudi sredstvo za lajšanje glavobola, kot je aspirin.
Derivatne spojine benzena
-
Stiren
Stiren, znan tudi kot vinilbenzen ali feniletilen, je tekoči derivat benzena tako kot olje, ki nima barve in zlahka izhlapi, tudi dobro diši, čeprav v koncentraciji postane rahlo gnilo visoko. -
fenol
Fenol je spojina, ki ima kisle lastnosti in se pogosto uporablja kot antiseptik, ki ga pogosto imenujemo tudi karbolna kislina -
Alkilbenzen
Ko oksidira alkilbenzen, lahko tvori benzojsko kislino. Ta reakcija je neodvisna od števila atomov ogljika -
Nitrobenzen
Nitrobenzen je eksplozivna spojina, zato se ta nitrobenzen pogosto uporablja kot eksploziv -
Toluen
Toluen je brezbarvna tekočina, ki se ne raztopi v vodi in ima vonj po razredčenju barve -
Anilin
Anilin je benzenska spojina, ki se veže na aminsko skupino -
Benzojska kislina
Benzojska kislina je najpreprostejša aromatična karboksilna kislina. Benzojska kislina je trdna snov bele barve. Benzojska kislina se pogosto uporablja pri sintezi drugih kemikalij
Uporaba benzena in njegovih potomcev
Benzen se običajno uporablja kot surovina za izdelavo drugih kemičnih spojin, kot so etilbenzen, cikloheksan in kumen. Ta derivat benzena se pogosto uporablja tudi za izdelavo drugih spojin.
Tako je razlaga definicije benzena, lastnosti, strukture, nomenklature, derivatov in razvrstitve, upajmo, da je opisano lahko koristno za vas. Hvala vam
Poglej tudiRazumevanje kloroplastov, funkcij, struktur in njihovega delovanja
Poglej tudiDavki: opredelitev, funkcije, ugodnosti in vrste po mnenju strokovnjakov
Poglej tudiRazumevanje BUMS, značilnosti, funkcije, vrste, cilji in primeri
