Definicija jonskih vezi, izrazi, značilnosti, lastnosti, tvorba, primeri
Opredelitev ionske vezi
Ta ionska vez je vez, ki nastane kot posledica privlačne sile med pozitivnimi in negativnimi ioni. Ti pozitivni ioni nastanejo, ker kovinski elementi izgubijo elektrone, medtem ko negativni ioni nastanejo, ker nekovinski elementi pridobivajo elektrone. Ta ionska vez nastane zaradi prenosa elektronov.
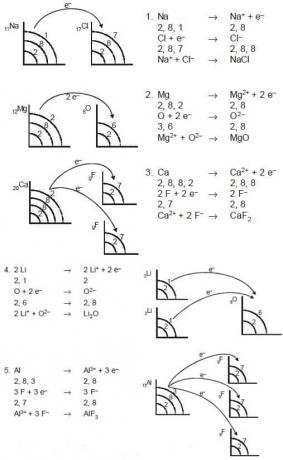
Ta ionska vez nastane kot rezultat procesa izgube ali tudi sprejemanja elektronov z vezanjem atomov. Atomi, ki izgubijo elektrone, postanejo pozitivni ioni (kationi), medtem ko atomi, ki sprejemajo elektrone, postanejo negativni ioni (anioni). Te ionske vezi se običajno imenujejo elektrovalentne vezi. Spojine, ki imajo ionske vezi, imenujemo ionske spojine. Te ionske spojine običajno nastanejo med atomi kovinskih in nekovinskih elementov. Atomi kovinskih elementov ponavadi izgubljajo elektrone, da tvorijo pozitivne ione, atomi nekovin pa običajno pridobivajo elektrone in tvorijo negativne ione. Primeri so: MgO, CaF2, NaCl, Li2O, AlF3 in drugi.
Pogoji za tvorbo atomskih vezi
Atomi nato tvorijo ionske vezi, ker želi vsak od teh atomov doseči ravnovesje / stabilnost, kar je podobno elektronski strukturi plemenitih plinov. Ionske vezi se tvorijo med naslednjim:
- pozitivni ioni z negativnimi ioni,
- Ti atomi imajo majhno ionizacijsko potencialno energijo z atomi velike afinitete do elektronov (atomi elementov skupine IA, IIA z atomi skupine VIA, elementov VIIA),
- Atomi z majhno elektronegativnostjo so atomi z veliko elektronegativnostjo.
Ionska vez je vez, ki nastane zaradi prenosa elektronov z enega atoma na drugega (James E. Brady, 1990). Jonska vez je med atomom, ki se preda elektronom (kovina), in atomom, ki pridobi elektrone (nekovina). Kovinski atom se po sprostitvi elektronov spremeni v pozitiven ion.
Čeprav ta atom ni kovina, se po prejemu elektronov spremeni v negativni ion. Med ioni, katerih naboji so nasprotni, potem obstaja privlačnost (elektrostatična sila), ki se imenuje ionska vez (elektrovalentna vez). Spojine, ki imajo ionske vezi, imenujemo ionske spojine. Te ionske spojine običajno nastanejo med atomi kovinskih in nekovinskih elementov.
Oblikovanje ionskih vezi
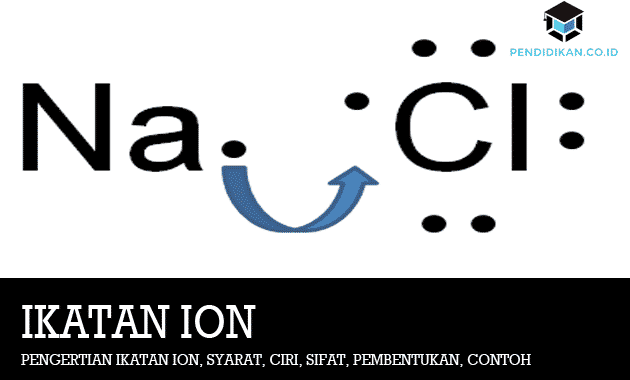
Postopek tvorjenja ionskih vezi je ponazorjen s tvorbo NaCl. Natrij (Na) je v elektronski konfiguraciji (2,8,1) bo bolj stabilna, če bo sprostila 1 elektron, tako da se bo potem konfiguracija elektronov spremenila v (2,8). Kar zadeva klor (Cl), ki ima in / ali ima konfiguracijo (2,8,7), bo bolj stabilen, če bo dobil 1 elektron, tako da bo konfiguracija nato postala (2,8,8). Torej, da potem ta dva postaneta bolj stabilna, nato natrij donira 1 elektron, klor pa dobi elektron iz natrija.
Ko natrij izgubi en elektron, ta natrij postane manjši. Medtem ko bo klor zaradi dodajanja enega elektrona postal večji. Zato je velikost pozitivnega iona vedno manjša od prejšnje velikosti, vendar bo za negativni ion ponavadi večja od prejšnje velikosti. Ko pride do izmenjave elektronov, bo Na postal pozitivno nabit (Na +), Cl pa negativno nabit (Cl-). Po tem med Na + in Cl obstaja elektrostatična sila, ki tvori ionske vezi.
Kot smo že omenili, je ionska vez vez, ki nastane zaradi prenosa elektronov z enega atoma na drugega. Ne smemo pozabiti, da bodo vezi med temi elementi stabilne, če sta najbolj oddaljena elektrona 2 in 8. nato si oglejte primer tvorbe ionskih vezi med elementi Na (natrij) in tudi Cl (klorid) spodaj:

Jonske vezi so razmeroma močne vezi. Pri sobni temperaturi so vse te ionske spojine kristalne trdne snovi in imajo določene strukture. Z uporabo Lewisovega simbola je tvorba NaCl opisana na naslednji način.

Simbol Lewisove elektronske pike je sestavljen iz simbola elementa in pik na vsaki točki, ki predstavljajo 1 valentni elektron atoma elementa. Elektronske pike so najbolj oddaljeni elektroni.

Lastnosti ionske vezi

Poleg svoje razmeroma močne narave ima ta ionska vez tudi več drugih lastnosti, med drugim naslednje:
- Ima visoko vrelišče in tališče. Pozitivni ioni in tudi negativni ioni v kristalih teh nesvobodnih ionskih spojin se premikajo, ker jih vežejo močne elektrostatične sile. Visoke temperature so potrebne, da ioni pridobijo dovolj kinetične energije za premagovanje elektrostatičnih sil.
- Trda, a krhka. Ima trde lastnosti, ker so pozitivni in negativni ioni v vseh smereh močno vezani z elektrostatičnimi silami. Krhkost je posledica dejstva, da se lahko plasti, kadar so izpostavljene zunanjim silam, premaknejo ali se lahko premaknejo, lahko pa se ti ioni lahko ali pa je lahko ena na drugi, tako da potem nastane zelo močna odbojnost, ki potem povzroči, da se zgodi ločitev.
- Je trdna snov pri sobni temperaturi.
- Topen v topilu v vodi, v bistvu pa netopen v organskih topilih
- Elektrike ne prevaja v trdni fazi, elektriko pa v tekoči fazi. Snov naj bi bila sposobna prevajati elektriko, če obstajajo ioni, ki se lahko ali se lahko prosto gibljejo in nosijo električni naboj.
Značilnosti ionskih vezi
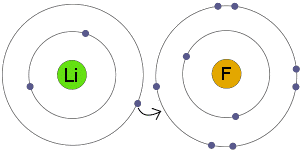
Prisotnost ionskih vezi vpliva tudi na kemijske in fizikalne lastnosti nastale spojine. Obstaja nekaj teh izjemnih lastnosti ionskih vezi, spodaj pa je seznam nekaterih naslednjih značilnosti ionskih vezi:
Ker te kovine običajno izgubljajo elektrone, nekovine pa pridobivajo elektrone, so ionske vezi pogoste med kovinami in nekovinami. Zato se v nasprotju s kovalentnimi vezmi, ki se lahko ali lahko tvorijo le med nekovinami, take ionske vezi lahko ali lahko tvorijo med kovinami in nekovinami.
Med poimenovanjem ionskih spojin je ime te kovine vedno na prvem mestu, ime nekovine pa na drugem mestu. Na primer, v primeru natrijevega klorida (NaCl) je natrij kovina, klor pa nekovina.
Spojine, ki vsebujejo ionske vezi, so enostavno topne v vodi, pa tudi v nekaterih drugih polarnih topilih. Ionska vezava torej vpliva na topnost nastale spojine.
Ko se te ionske spojine raztopijo v topilu in tvorijo homogeno raztopino, raztopina ponavadi prevaja elektriko.
Te ionske vezi vplivajo tudi na tališče spojine, ker te ionske spojine ponavadi višje tališče, kar pomeni, da ionska vez ostane stabilna v širšem temperaturnem območju velik.
Jonska veza nastane zaradi privlačnosti med pozitivno nabitimi ioni in negativno nabitimi ioni.
Kot navaja Wibowo (2013), je treba upoštevati več stvari, običajno je v tem kemičnem vezivnem materialu napaka, na primer naslednji primer:
- Ta ionska vez se lahko pojavi ali pa lahko nastopi le med enostavnimi kationi in anioni,
- Te ionske spojine lahko nastanejo ali se lahko tvorijo neposredno iz ionov itd.
V formuli ali tudi ionski formuli. Te ionske spojine ne obstajajo kot molekule, zato o molekularnih formulah ionskih spojin ne moremo ali ne moremo vedeti. Namesto tega je ionska formula v spojini empirična formula te spojine. Na primer, natrijev klorid ima formulo NaCl.
Saunders (2007) je izjavil, da je v ionski rešetki več enakih količin ionov, na primer:
- Magnezijev oksid vsebuje ione Mg2 + in O2-, formula pa je MgO
- Kalcijev klorid vsebuje ione Ca2 + in Cl2-, njegova formula pa je CaCl2
- Ta aluminijev oksid vsebuje ione Al3 + in O2- in njegova formula je Al2O3
Primer tvorbe ionske vezi NaCl
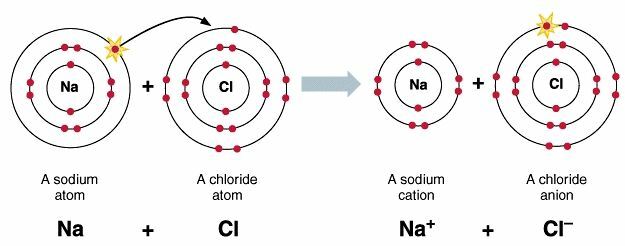
Ko se atom Na približa Cl, potem Na prevzame določeno ionizacijsko energijo, tako da lahko nato sprosti elektron in se spremeni v Na⁺ ione.
Na = 2. 8. 1> nato absorbira energijo in tvori Na⁺ ione
Cl = 2. 8. 7> bo nato sprostil energijo in tvoril ione Cl⁻.
Elektrone, ki jih sprosti atom Na, bo nato sprejel atom Cl, tako da se bo atom Cl spremenil v ion Cl⁻. Ta postopek vezave elektronov nato sprosti določeno energijo, ki je enaka njegovi afiniteti do elektronov.
Med ioni Na⁺ in Cl⁻ obstaja elektrostatična privlačnost, tako da se nato tvorijo ionske spojine NaCl.
Tako je razlaga definicije ionskih vezi, izrazov, značilnosti, lastnosti, tvorbe in primerov, upam, da je opisano lahko koristno za vas. Hvala vam
Poglej tudiRazumevanje jajčnikov, zgradbe in delov ter njihovih funkcij
Poglej tudiOpredelitev Straight Motion
Poglej tudiRazumevanje elektroskopa
