Stechiometria chémia: pojmy, typy, príklady
Načítava...
Pojem stechiometria je veda v chémii, ktorá je základom pre výpočet kvantitatívneho vzťahu reaktantov a produktov, ktoré sa vyskytujú pri chemických reakciách. Vychádza z rovnice reakcie a základných zákonov.
Charakteristickým znakom stechiometrických reakcií je, že z reaktantov alebo reakcií nezostávajú žiadne zvyšky, pretože všetky boli spotrebované. Vo všeobecnosti sa tento materiál vyučuje v 10. ročníku strednej školy a často sa objavuje na rôznych školských skúškach. Tu je úplné vysvetlenie.
Zoznam obsahu
Stechiometrické chemické látky
Štúdium stechiometrie znamená, že musíte pochopiť niekoľko súvisiacich vecí. Niektoré z týchto vecí zahŕňajú základné zákony chémie, pojmy v chémii, ktoré spolu súvisia a ich typy. Potrebné sú aj cvičné otázky, aby ich porozumenie bolo zrelšie.
Základné zákony chémie pre stechiometriu
Existuje 5 základných zákonov v chémii, ktoré je dôležité poznať na pochopenie stechiometrie, vrátane:
1. Zákon zachovania omše

V roku 1789 chemik Lavoisier sformuloval zákon zachovania hmoty. Podstatou zákona o zachovaní hmotnosti je, že celková hmotnosť látky zostane rovnaká, pred aj po chemickej reakcii.
Napríklad hmotnosť dreva pred spálením s hmotnosťou výsledku spaľovania dreva sa nemení. Inými slovami, hmotnosť látky alebo predmetu vlastneného pred a po reakcii sa zachováva.
2. Zákon pevného porovnávania

Joseph Proust bol odborníkom, ktorý v roku 1799 vytvoril zákon pevných proporcií. Tento zákon hovorí, že pomer celkovej hmotnosti prvkov, ktoré tvoria konkrétnu zlúčeninu, sa nezmení alebo zostane konštantný.
Pre ilustráciu, pomer hmotností látky A a látky B obsiahnutých v roztoku je vždy konštantný a vôbec nie je ovplyvnený objemom roztoku.
3. Zákon viacnásobného porovnávania

Okrem toho, základný zákon stechiometrie, ktorý je potrebné pochopiť, je zákon viacerých pomerov, ktorý vytvoril John Dalton v roku 1803. Viacnásobné porovnania sú rozšírením zákona neustáleho porovnávania.
Zákon o viacerých pomeroch hovorí, že keď 2 prvky tvoria viac ako 2 zlúčeniny, ich celková hmotnosť je jeden zo základných prvkov je konštantný, potom celková hmotnosť ostatných základných prvkov je celé číslo jednoduché.
4. Gay Lussacov zákon
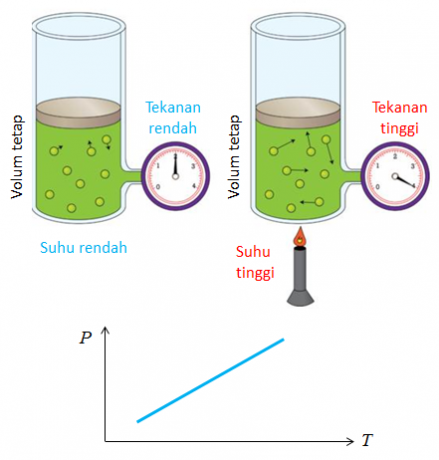
Ďalším názvom zákona, ktorý objavil Joseph Gay Lussac, je zákon o pomere objemov. Záver získaný zo zákona o objemovom porovnaní je, že teplota a tlak ovplyvňujú zmenu objemu plynu.
5. Avogadrova hypotéza
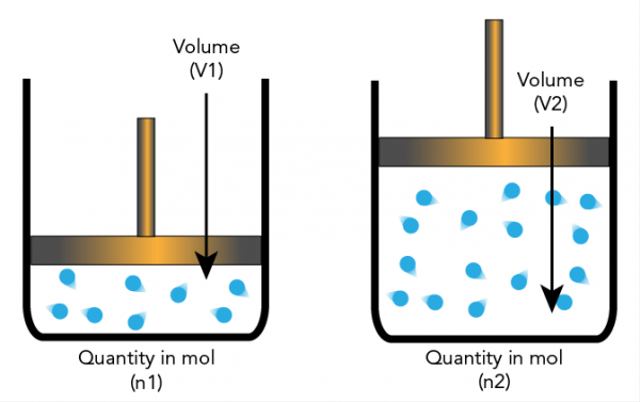
Amadeo Avogadro predložil hypotézu, že elementárne častice môžu byť molekuly a prvky, takže nie vždy sú atómami. To vedie k ďalším vysvetleniam, na ktorých je založená stechiometria.
Avogadrova hypotéza tvrdí, že ak teplota a tlak majú rovnaký počet, potom pomer plynov s rovnakým objemom bude mať rovnaký počet molekúl.
Čítať: Koloidný materiál
Chemické pojmy na pochopenie v stechiometrii
Nielen základné zákony, ale aj ďalšie dôležité veci, ktoré úzko súvisia so stechiometrickým materiálom, sú pojmy v chémii. Prinajmenšom existujú 4 pojmy, ktoré je potrebné pochopiť, a to relatívna atómová hmotnosť, relatívna molekulová hmotnosť, molarita a pojem mólov.
1. Relatívna atómová hmotnosť (Ar)
V chémii je skratka pre relatívnu atómovú hmotnosť Ar. Tento pojem sa vzťahuje na celkovú atómovú hmotnosť, ktorá sa určuje porovnaním so štandardnou celkovou atómovou hmotnosťou. Medzinárodná únia čistej a aplikovanej chémie používa atóm uhlíka ako štandard stanovenia.
Atóm uhlíka alebo izotop C-12 bol vybraný, pretože má stabilné jadro, ktoré je inertnejšie ako iné typy atómov. Inertný znamená odolnosť voči chemickým reakciám, ktoré sa vyskytujú.
2. Relatívna molekulová hmotnosť (Mr)
Okrem toho existuje pojem relatívnej molekulovej hmotnosti, ktorý sa označuje skratkou Mr. Pojem stechiometrie Mr je celková hmotnosť molekuly, ktorej meranie využíva jednotky atómovej hmotnosti.
Reklama
Na základe tohto konceptu majú rôzne molekuly s rovnakou zlúčeninou možnosť rozdielov v molekulovej hmotnosti, pretože izotopy, ktoré obsahujú, sú z rôznych prvkov.
3. Mol Concept
Chémia má účtovnú jednotku na zjednodušenie procesu výpočtu, a to krtek. Koncept móla je založený na Avogadrovom čísle, ktoré predstavuje počet molekúl, atómov alebo iónov. Podľa tohto konceptu je 1 mol ekvivalentný 6,022 x 1023 častice látky.
Hmotnosť jedného mólu možno povedať, že je ekvivalentná Ar a Mr v gramoch. Napríklad celková hmotnosť molárnej hmotnosti uhlíka 12 g/mol sa rovná Ar uhlíka 12 amu.
4. Molarita
Molarita je pojem v chémii, ktorý udáva počet mólov rozpustenej látky prítomnej v 1 litri rozpúšťadla. Inými slovami, molarita sa týka koncentrácie, ktorú má množstvo rozpustenej látky na jednotku objemu.
Čítať: Vzorec molarity
Typy chemickej stechiometrie

Upozorňujeme, že existujú 3 typy stechiometrie, a to reakcie, plyny a zlúčeniny alebo kompozície. Tu je úplné vysvetlenie:
1. Stechiometria reakcie
Definícia reakčnej stechiometrie je typ koncepcie, ktorá zdôrazňuje kvantitatívny vzťah medzi látkami prítomnými v konkrétnej chemickej reakcii. Tento koncept sa používa na vyváženie chemických rovníc, ktoré sa vyskytujú.
Na základe tohto vysvetlenia možno povedať, že látky, ktoré sa podieľajú na chemickej reakcii, ovplyvňujú kvantitatívny vzťah medzi týmito látkami.
2. Stechiometria plynu
Ďalej, stechiometria plynu sa týka konceptu chemických reakcií, v ktorých sú prítomné plyny. Plyn pri určitom tlaku, teplote a objeme sa považuje za ideálny plyn. Plyn pozostáva len z jednej sady častíc, ktorých pohyb je náhodný a neinteraguje.
Rovnica ideálneho plynu je vyjadrená P.V = n. R.T. Vo vzorci je P tlak v atm, V je objem plynu v litroch, n je počet mólov, T je teplota 273 K a R je plyn 0,082 l atm/mol K.
3. Zložená stechiometria
Definícia stechiometrie zlúčeniny alebo kompozície je pojem, ktorý vyjadruje kvantitatívny vzťah celkovej hmotnosti alebo množstva látky, ktoré prvky v konkrétnej zlúčenine majú.
Tento koncept sa často používa na vysvetlenie celkovej hmotnosti vodíka a dusíka, ktoré sa spojili a vytvorili komplexný amoniak.
Čítať: Vzorec hustoty
Príklady problémov stechiometrie a diskusie

Ako riešiť problémy súvisiace so stechiometriou. Nasleduje príklad otázky a jej diskusie, aby bolo ľahšie porozumieť:
1. Nájdite počet každého atómu obsiahnutého v 2 móloch H2O!
Treba poznamenať, že H2O má 2 atómy H a 1 atóm O. Potom je riešením:
Počet atómov H = 2 2 mol 6,02. 1023 atómov/mol = 24,08. 1023 atóm. Takže počet atómov obsiahnutých v 2 móloch H je 24,08. 1023.
Teraz spočítajte počet atómov, ktoré vlastní atóm O, a to:
Počet atómov O = 1 2 mol 6,02. 1023 atómov/mol = 12,04. 1023 atóm. Na základe týchto výpočtov je možné vidieť, že počet atómov v 2 móloch O je 12,04. 1023.
2. Vypočítajte celkovú hmotnosť alebo hmotnosť, ktorú majú 2 móly C6H12O6 (glukóza)! Je tiež známe, že súčet Ar C = 12, O = 16 a H = 1.
Riešenie:
Z otázky je možné vidieť nasledujúce informácie:
n = 2 mol
pán C6H12O6 = (6 Ar C) + (12 1) + (6 16)
= 180
Ďalej sa výpočet zmení na:
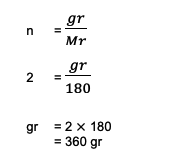
Celková hmotnosť 2 mólov glukózy alebo C6H12O6 až 360 gramov na základe týchto výpočtov.
Jednou z dôležitých tém v chémii je stechiometria, ktorá je základným konceptom výpočtu na zistenie kvantitatívneho vzťahu medzi chemickými rovnicami a vzorcami. Je potrebné pochopiť aj niekoľko ďalších pojmov v chémii, pretože súvisia so stechiometriou.
X ZATVORENÉ
Reklamy
REKLAMA
X ZATVORENÉ
