Vzorce molarity a molality a príklady problémov
Načítava...
Koligatívnosť roztoku je jednou z chemikálií triedy XI SMA. Aby ste porozumeli tomuto materiálu, musíte dobre ovládať vzorce molarity a molality roztoku, pretože táto kapitola má úzky vzťah s koncentráciou roztoku.
Pre tých z vás, ktorí nevedia, roztok je homogénna zmes rozpúšťadiel (zvyčajne voda alebo H2O) s rozpustenou látkou. Aby sme vám uľahčili pochopenie tohto materiálu, uvádzame ho od pochopenia až po príklady otázok o molarite a molalite riešenia.
Zoznam obsahu
Pochopenie molarity

Molarita je miera rozpustnosti, ktorá vyjadruje počet mólov rozpustenej látky na objem roztoku. Symbol molarity je označenie M (veľké), pričom molárne jednotky sú ekvivalentné molom/liter.
Čítať: Acid Base
Vzorec molarity

Ak skôr bolo chápanie molarity, čo potom vzorec? Tu je vzorec molarity:
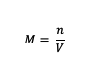
M = molarita látky (molárna alebo mol/l)
n = móly látky (móly)
V = objem roztoku (ml)
Okrem vyššie uvedeného vzorca môžete molaritu vypočítať aj pomocou nasledujúceho vzorca:
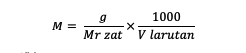
M = molarita látky (molárna alebo mol/l)
g = hmotnosť látky (gramy)
Mr = relatívna molekulová hmotnosť látky (gramy/mol)
V = objem roztoku (ml)
Ak je roztok zmiešaný, platí vzorec:
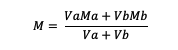
Va = objem látky a
Vb = objem látky b
Ma = molarita látky a
Mb = molarita látky b
Ak je roztok zriedený, potom platí vzorec molarity:
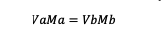
Va = objem látky a
Vb = objem látky b
Ma = molarita látky a
Mb = molarita látky b
Aby ste získali mólovú hodnotu, musíte ju vypočítať pomocou nižšie uvedeného vzorca:
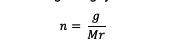
n = móly látky (móly)
g = hmotnosť látky (gramy)
Mr = relatívna molekula látky (gramy/mol)
Definícia molality

Na prvý pohľad podobné, ale odlišná molarita vieš s molalitou!
Molalita alebo molálna koncentrácia je počet mólov rozpustenej látky na jeden kilogram rozpúšťadla. Podľa definície je molalita veličina, ktorá udáva počet mólov rozpustenej látky na jednotku hmotnosti rozpúšťadla. Molalita sa označuje zápisom m (malý).
Čítať: Ohmov zákon
Molality vzorec

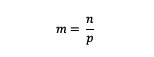
m = molalita látky (molalita)
n = móly látky (móly)
p = hmotnosť rozpúšťadla (gramy)
Okrem toho môžete molalitu vypočítať aj pomocou nasledujúceho vzorca:
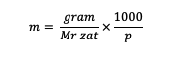
m = molalita látky (molalita)
Mr = relatívna molekula látky (gramy/mol)
p = hmotnosť rozpúšťadla (gramy)
Rozdiel medzi vzorcami molarity a molality
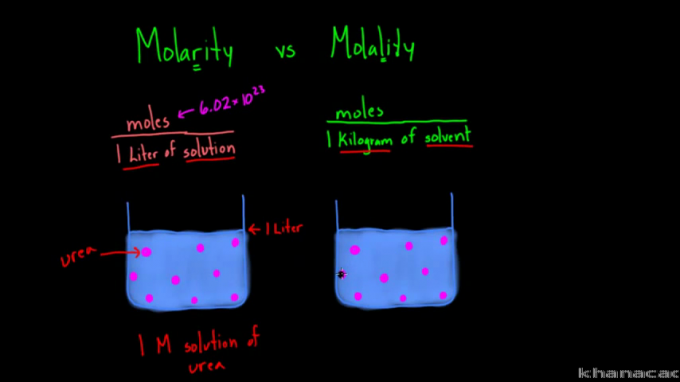
Pojmy „molarita“ a „molalita“ často spôsobujú, že niektorí ľudia sú zmätení, pretože majú podobné písanie a výslovnosť. Hoci sa oba používajú na meranie koncentrácie roztoku, existujú medzi nimi rozdiely.
Na základe vyššie uvedeného vzorca možno vidieť, že rozdiel medzi molaritou a molalitou spočíva v prístupe. Molarita alebo molárna koncentrácia meria počet mólov látky na liter roztoku. Zatiaľ čo molalita meria počet mólov látky na kilogram rozpúšťadla.
Reklama
Čítať: Obchodný vzorec
Príklady problémov s molaritou a diskusia

Teraz, keď poznáte vzorec pre molaritu a molalitu, bolo by lepšie, keby ste sa okamžite pokúsili pracovať na probléme, aby ste lepšie porozumeli materiálu. Poďte, položte nasledujúce otázky!
Problém molarity
1. Ak je známe, že hmotnosť rozpustenej látky je 11 gramov, objem roztoku je 500 ml a Mr = 22. Aká je molarita?
odpoveď:
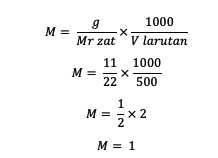
Takže molarita látky je 1 mol/l.
2. 5 M HCl s objemom 20 ml sa zriedil na 0,4 M. Koľko vody by sa teda malo pridať do roztoku?
odpoveď:
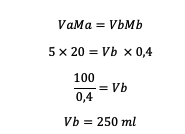
Množstvo vody, ktoré je potrebné pridať, je teda 250 ml.
3. Glukóza (C6H12O6), ktorý má relatívnu hmotnosť 180, je prítomný v 500 ml 0,1 M roztoku glukózy. aká je hmotnosť glukózy?
odpoveď:

Takže hmotnosť, ktorú má glukóza (C6H12O6) je 9 gramov.
4. Aký je objem rozpúšťadla v H. roztoku?2SO4 0,2 M, ktorého rozpustená látka je 0,3 molu?
odpoveď:
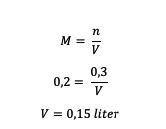
Objem rozpúšťadla je teda 0,15 litra.
5. Celkovo 18 gramov glukózy (C6H12O6) s Mr = 180 sa rozpustí vo vode tak, aby objem bol 0,5 l. Aká je molarita roztoku?
odpoveď:

Najprv vypočítajte počet krtkov
Ďalej vypočítajte hodnotu molarity.
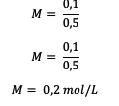
Takže molarita roztoku glukózy je 0,2 mólu na liter.
6. Koľko gramov NaOH (Mr = 40) sa musí rozpustiť, aby sa vyrobilo 100 ml 01 M roztoku NaOH?
odpoveď:

Takže to trvá 0,4 gramu požadovanej hmotnosti NaOH.
Problém molality
1. Je známe, že roztok má hmotnosť 11 gramov rozpustenej látky, 200 gramov rozpúšťadla a Mr = 22. Takže, čo je molalita?
odpoveď:
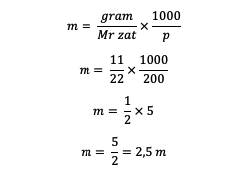
Takto sa získa hodnota molality 2,5 m.
2. Do 17,1 g roztoku trstinového cukru, ktorý má Mr = 342, sa pridá celkom 250 gramov vody. Aká je molalita roztoku?
odpoveď:

Molalita roztoku je teda 0,2 m.
3. Akú molalitu má roztok 4 gramov NaOH (ak je známe, že Ar Na = 23, O = 16, H = 1) rozpusteného v 250 gramoch vody?
odpoveď:
Pred výpočtom molality musíme najprv vypočítať relatívnu hmotnosť.
Mr = 23 + 16 + 1 = 40 gramov/mol
Potom vypočítajme molalitu.
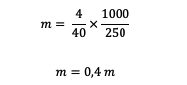
Takže molalita obsiahnutá v roztoku NaOH je 0,4 m.
4. Aká je molalita 37 % roztoku HCl, ak je známe, že Ar H = 1 a Ar Cl = 35,5?
odpoveď:
Mr = 1 + 35,5 = 36,5 gramov/mol
Hmotnosť HCl = 37 % x 100 gramov = 37 gramov
Hmotnosť rozpúšťadla = hmotnosť roztoku – hmotnosť HCl
Hmotnosť rozpúšťadla = 100 – 37 gramov
Hmotnosť rozpúšťadla = 63 gramov alebo 0,063 kilogramu
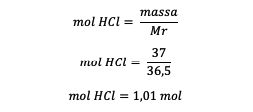
Po poznaní mólov HCl potom vypočítajte molalitu
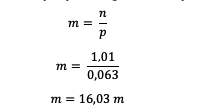
Je teda možné vidieť, že molalita HCl je 16,03 mol.
5. Aká je molalita 15 gramov močoviny CO(NH .?2)2 rozpustený v 250 gramoch vody? (Pán = 60)
odpoveď:
Najprv vypočítajte móly močoviny
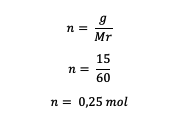
Ďalej vypočítajte molalitu roztoku
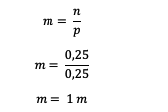
Molalita roztoku močoviny je teda 1 m.
No, to je vzorec pre molaritu a molalitu sprevádzaný definíciou a príkladmi problému. Ľahké nie? Dúfame, že prostredníctvom tohto článku môžete zlepšiť svoje porozumenie, Áno. Duchu!
X ZATVORENÉ
Reklamy
REKLAMA
X ZATVORENÉ
