Valenčné elektróny: Definícia, Ako vypočítať, Príklady
Načítava...
Valenčné elektróny sú elektróny na najvzdialenejšej úrovni atómu, ktoré sa môžu podieľať na interakciách s inými atómami. Hodnota valencie môže predstavovať atóm, takže je možné vidieť hodnotu interakcie.
Počet valencií v atóme môže spôsobiť, že prvok bude reaktívny alebo neaktívny. Z tohto dôvodu je veľmi dôležité poznať počet valencií, aby sme mohli poznať aktivitu príbuzného prvku.
Zoznam obsahu
Pochopenie valenčných elektrónov
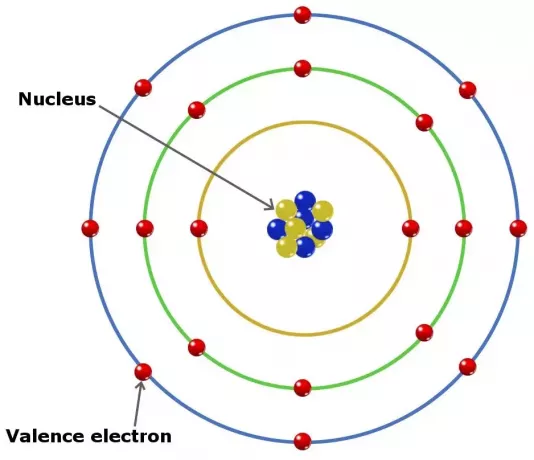
Valenčné elektróny v atómoch môžu hrať úlohu pri vytváraní chemickej väzby v prvku. V prvkoch v hlavnej skupine sú valenčné elektróny elektróny vo vonkajšom obale.
Aj tak, ale nie všetky tieto typy elektrónov sú vo vonkajšom obale. V niektorých prvkoch patriacich do prechodnej skupiny je valencia hlbšia ako vonkajší obal.
Čítať: Konfigurácia elektrónov
Valencový elektrónový stôl
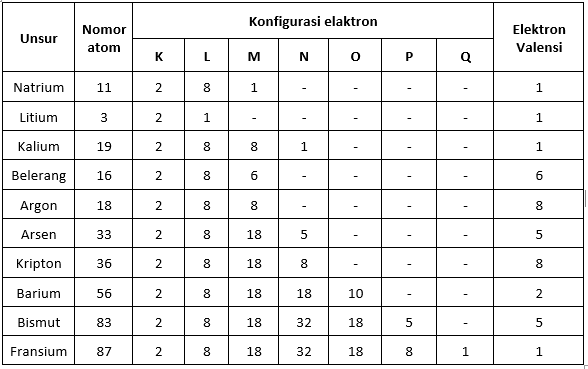
Valenčné elektróny a periodický systém prvkov
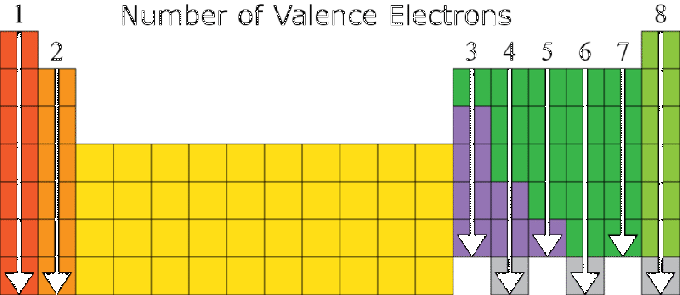
Vlastnosti prvku sú veľmi závislé od jeho elektrónovej konfigurácie, najmä od jeho valenčného čísla. Prvky s rovnakým počtom valencií majú vo všeobecnosti podobné vlastnosti. Z tohto dôvodu je periodický systém prvkov usporiadaný na základe rastúceho atómového čísla a podobnosti vlastností látky.
Existuje vzťah medzi elektrónovou konfiguráciou atómu prvku a polohou prvku v periodickom systéme, kde:
- Číslo skupiny je rovnaké ako počet valenčných hodnôt, okrem prvku He v skupine VIIIA a prechodnej skupine.
- Číslo periódy sa rovná počtu obalov na elektróne.
Elektrická vodivosť
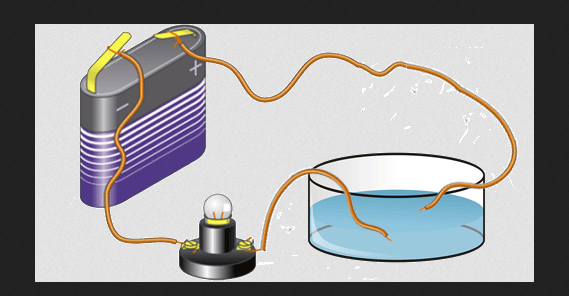
Valenčné elektróny sú tiež zodpovedné za elektrickú vodivosť prvku. To spôsobuje, že prvky môžu byť zoskupené ako nekovy, polovodiče a kovy. Kovové prvky majú vo všeobecnosti vysokú elektrickú vodivosť, keď sú v pevnom stave.
V každom riadku periodickej tabuľky je kov naľavo od nekovu. Takže kovy majú menej valencií ako nekovy.
Avšak valenčná hodnota atómov kovu má malú ionizačnú energiu a v pevnom stave môžu tieto elektróny relatívne voľne opustiť 1 atóm alebo sa môžu spojiť s inými atómami.
Voľné elektróny ako tento sa môžu pohybovať vplyvom elektrického poľa, ich pohyb môže obsahovať elektrický prúd. Tieto elektróny sú zodpovedné za elektrickú vodivosť kovov. Príklady dobrých vodičov sú hliník, meď, zlato a striebro.
Nekovové prvky majú nízku elektrickú vodivosť, takže fungujú ako izolanty. Prvky, ako je tento, možno vidieť v periodickej tabuľke napravo a majú valenčnú škrupinu, ktorá je aspoň z polovice plná.
Ionizačná energia je údajne veľká, ak elektróny nemôžu ľahko opustiť atóm, keď sú konfrontované s elektrickým poľom. Takže tento druh prvku má schopnosť viesť veľmi malé prúdy.
Príklady izolačných prvkov zahŕňajú síru a diamant. Pevné zlúčeniny obsahujúce kovy možno tiež považovať za izolátory, ak sa na vytvorenie iónovej väzby použije valencia atómov kovu.
Čítať: Kvantová mechanika
Konfigurácia elektrónov
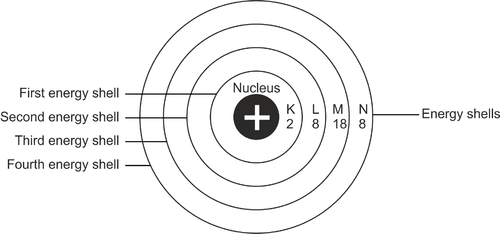
O konfiguračnom procese možno povedať, že ide o usporiadanie rozloženia elektrónov v atóme. Vo všeobecnosti budú elektróny v atóme na určitej dráhe. Určuje sa na základe energetickej hladiny atómu. Tieto dráhy sú elektrónové obaly.
Prvá časť vrstvy kože je označená písmenom K. Vrstvy kože budú pokračovať do L, M atď. v abecednom poradí. Obal K je najbližšie k atómovému jadru. Každá vrstva obalu môže pojať len určitý počet elektrónov.
Reklama
Ak je teda plná, elektróny sa presunú do ďalšej vrstvy. Všetky vrstvy kože musia byť vyplnené na maximálnu kapacitu.
Ako spočítať valenčné elektróny

Poloha elektrónov, keď začnú vypĺňať atóm, začína od prvej vrstvy obalu. Táto vrstva kože je najbližšie k atómovému jadru alebo je označená písmenom K. Prvá vrstva má najnižšiu energetickú hladinu. Ak je prvá vrstva naplnená 2 elektrónmi, bude sa pokračovať vyplnením ďalšej vrstvy nazývanej L.
L obal má kapacitu 8 elektrónov. Ak je plná, postupuje sa postupne do ďalšej vrstvy pokožky. Celková kapacita vonkajšieho obalu atómu je 8 elektrónov.
Prvky patriace do hlavnej skupiny, ich elektrónová konfigurácia môže byť určená na základe počtu elektrónov alebo atómového čísla podľa nasledujúcich pravidiel.
- Elektróny budú plne nabité na maximálnu hranicu, ktorú môže pojať vrstva kože.
- Ak ešte stále zostávajú elektróny alebo nemôžu maximálne vyplniť vrstvu elektrónového obalu, venujte pozornosť nasledujúcim ustanoveniam.
- Ak je počet zostávajúcich elektrónov > 32, ďalšia časť obalu je vyplnená 32 elektrónmi
- Ak zostávajúce elektróny < 32, ďalšia vrstva obalu pojme 18 elektrónov;
- Ak je počet zostávajúcich elektrónov < 18, ďalšia vrstva bude vyplnená 8 elektrónmi.
- Ak je zostávajúce číslo 8, zostávajúce elektróny môžu vyplniť ďalšiu časť obalu.
Čítať: Fyzická zmena
Príklady problémov s valenčnými elektrónmi

Aby ste materiál porozumeli hlbšie, pozrite si niekoľko príkladov a nasledujúcu diskusiu.
Príklad 1
Určte valenčné hodnoty nasledujúcich prvkov na základe ich elektrónových konfigurácií.
- 11Na
- 13Al
- 15P
- 18Ar
- 19K
odpoveď:
- 11Na = 281
Počet valencií Na = 1
- 13Al = 283
Počet valencií Al = 3
- 15P = 285
Celková valencia P = 5
- 18Ar = 288
Počet valencií Ar = 8
- 19K = 2 8 8 1
Počet valencií K = 1
Príklad 2
Vytvorte elektrónovú konfiguráciu a určte valenčné hodnoty nasledujúcich prvkov pomocou konfigurácií elektrónov vzácnych plynov.
- 20Ca
- 35br
- 36Cr
- 50Sn
- 86Rn
odpoveď:
- 20Ca = [Ar] 4s2
Súčet valenčných hodnôt Ca = 2
- 35Br = [Ar] 3d10 4s2 4p5
Súčet valenčných hodnôt Br = 7
- 36Kr = [Ar] 3d10 4s2 4p6
Súčet valenčných hodnôt Kr = 8
- 50Sn = [Kr] 4d10 5 s2 5p2
Súčet valenčných hodnôt Sn = 4
- 86Rn = [Xe] 4f14 5d10 6 s2 6p6
Súčet valenčných hodnôt Rn = 8
Príklad 3
Napíšte elektróny prvkov nižšie a tiež určte ich valenčné hodnoty.
- 10 Nie
- 33 USA
- 47 Ag
- 52 Te
- 54 Xe
odpoveď:
- 10 Nie: 1 s2 2s2 2p6
Súčet valenčných hodnôt Ne = 8
- 33 Eso: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p3
Súčet valenčných hodnôt As = 5
- 47 Ag: 1 s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d10
Súčet valenčných hodnôt Ag = 1
- 52 Te: 1 s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5 s2 4d10 5p4
Súčet valenčných hodnôt Te = 6
- 54 Xe: 1 s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5 s2 4d10 5p6
Súčet valenčných hodnôt Xe = 8
Valenčné elektróny možno určiť na základe špecifikovanej dráhy alebo orbity pomocou elektrónovej konfigurácie. Aj keď to vyzerá dosť komplikovane, zvládnutie tohto materiálu je niečo, čo je potrebné urobiť, aby ste mohli ľahko pracovať na otázkach.
X ZATVORENÉ
Reklamy
REKLAMA
X ZATVORENÉ
