ZLÚČENINY: Definícia, Typy, Príklady
Načítava...
Bez toho, aby si to ľudia uvedomovali, často prichádzajú v každodennom živote do kontaktu s rôznymi typmi zlúčenín. Aj keď možno nie každý si uvedomuje, nieto chápe, čo zlúčenina znamená. V skutočnosti existuje veľa príkladov zlúčenín, ktoré sa často nachádzajú, ako je soľ, cukor, voda atď.
Vo všeobecnosti sú zlúčeniny klasifikované do niekoľkých typov na základe základných prvkov. Zatiaľ čo proces rozkladu zlúčenín sa uskutočňuje chemickou reakciou. Tiež rozlišuje formu, štruktúru, chuť a vôňu každého typu zlúčeniny.
Zoznam obsahu
Pomenovanie zložených vzorcov
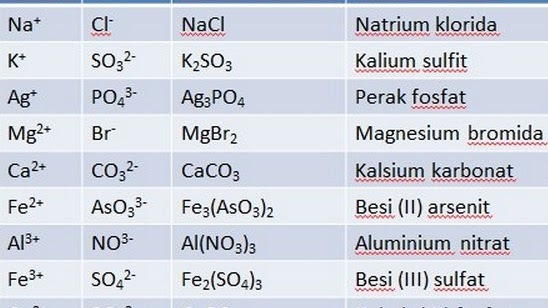
Zlúčenina je jedna látka, ktorá sa môže chemickou reakciou rozložiť na dve alebo viac látok. Príkladom zlúčeniny, ktorá sa často vyskytuje v každodennom živote, je voda. Voda je v tomto procese kombináciou prvkov kyslíka (O) a vodíka (H) s chemickým vzorcom H20.
V správe z oficiálnej stránky Ministerstva školstva a kultúry Indonézskej republiky sa uvádza, že najmenšou časťou prvku je atóm. Ak sa dva atómy spoja chemickou reakciou, vytvoria molekulu alebo najmenšiu časť zlúčeniny.
Medzitým proces tvorby zlúčenín prostredníctvom chemického miešania a tepelného alebo elektrického rozkladu. Zlúčeniny majú odlišné vlastnosti od ich základných prvkov.
Napríklad vlastnosti vody sa líšia od vlastností prvkov, ktoré ju tvoria, a to kyslíka a plynného vodíka. Rozdiel vo vzhľade je tiež veľmi reálny. Pretože voda je kvapalina, vodík je plyn. Okrem toho možno na hasenie požiarov použiť vodu.
Vodík je však horľavá látka. Zatiaľ čo kyslík je látka potrebná v procese spaľovania. Je teda možné vidieť, že základné prvky a výsledné zlúčeniny majú veľmi opačné vlastnosti, formy a funkcie.
Aký je teda rozdiel medzi zlúčeninou a zmesou a prvkom? Hoci zlúčeniny a prvky sú jednotlivé látky. Existujú však rozdiely medzi zlúčeninami a prvkami, ako aj zmesami.
Je to preto, že prvok je jediná látka, ktorú nemožno premeniť na jednoduchšie látky a prvok si stále zachová svoje pôvodné vlastnosti alebo charakteristiky.
Príklad prvkov:
- Zlato
- Viesť
- železo
- Meď
- Zinok
- nikel
Zmes je materiál zložený z dvoch alebo viacerých látok, no stále má vlastnosti pôvodnej látky. Príklady zmesí zahŕňajú:
- Vzduch
- Riečna voda
- Rock
- Čokoládové mlieko
- Jódová soľ
- Káva
- Sladký čaj
Čítať: Kvapalina
Typy zlúčenín
Predtým, ako budeme ďalej diskutovať o absolútnych príkladoch zlúčenín v každodennom živote. Je dobré, ak dokážete rozlíšiť aj typy zlúčenín.
Na základe základných prvkov sú zlúčeniny kategorizované do niekoľkých typov, a to nasledovne:
1. Organická zlúčenina

Pochádza zo živých vecí a procesu fotosyntézy. Organické zlúčeniny obsahujú ako hlavný reťazec uhlík (C). Tento typ organickej zlúčeniny má charakteristické vlastnosti, že je nerozpustný vo vode a je rozpustný iba vtedy, ak je zmiešaný s organickými rozpúšťadlami.
Pretože sa tvorí z prvku uhlíka (C), spôsobuje, že organické zlúčeniny majú tendenciu byť horľavejšie. Príkladom organickej zlúčeniny je cukor (C12H22011)
2. Anorganická zlúčenina
Reklama

Tento typ zlúčeniny pochádza z nerastných surovín. Anorganické zlúčeniny majú relatívne vyššie teploty varu ako organické zlúčeniny. Anorganické zlúčeniny však bývajú nehorľavé a ľahko rozpustné vo vode. Napríklad oxid kremičitý (SiO2).
3. Kyslé

Molekuly, ktoré môžu darovať vodíkové ióny H+ a tvorí kovalentnú väzbu s Lewisovou kyselinou. V chémii sa kyslé zlúčeniny skladajú z troch definícií, a to Arrhenius, Bronsted-Lowry a Lewis.
Vo všeobecnosti majú kyseliny nasledujúce vlastnosti:
- Kyslé, keď sa rozpustí vo vode.
- Pri zmiešaní s kovmi reaguje prudko.
- Na dotyk štípe a má potenciál poškodiť pokožku.
- Majú pH nižšie ako 7.
- Kyseliny sú elektrolyty, aj keď nie nevyhnutne iónové.
- Dokáže zmeniť modrý lakmusový papier na červený.
Kyseliny majú rôzne použitia, vrátane odstraňovania hrdze z kovových predmetov morením alebo morením. Okrem toho možno kyselinu použiť aj ako elektrolyt v mokrých batériách. Kyselina sírová sa môže použiť ako katalyzátor na výrobu benzínu.
Čítať: Acid Base
4. Iónové zlúčeniny

Tento výraz sa vzťahuje na chemickú zlúčeninu pozostávajúcu z iónov držaných pohromade elektrostaticky (iónové väzby). Hoci je táto zlúčenina celkovo neutrálna, skladá sa z kladne nabitých iónov (katiónov) a záporne nabitých iónov (aniónov), oboje vo forme sodíka, chloridu až uhličitanu.
Vlastnosti iónových zlúčenín:
- Má veľmi vysoký bod varu s nízkym tlakom pár.
- Alkalita alebo podobnosť s kyslými zlúčeninami.
- Väčšina typov iónových zlúčenín je veľmi krehká.
- Stlačiteľnosť iónových zlúčenín je určená štruktúrou.
- Ľahko rozpustný v polárnych kvapalinách, ako je voda. Má však tendenciu byť ťažko rozpustný v benzíne.
- Nízka vodivosť a vo všeobecnosti nevedú významnú elektrinu.
Iónové zlúčeniny majú rôzne využitie a ľudia ich bežne používajú v každodennom živote. Príklady iónových zlúčenín zahŕňajú magnéziové mlieko, bórax až po hasené vápno.
5. Soľ

V chémii sa soľ kategorizuje na iónové zlúčeniny pozostávajúce zo záporných iónov (anióny) a kladných iónov (katióny), čím vznikajú zlúčeniny bez náboja alebo neutrálne. Soľ vzniká reakciou zásad a kyselín, ako je chlorid, acetát, fluorid, síran, na chlorid sodný.
Zo všetkých druhov soli, ktoré existujú, má každá soľ inú chuť, a to:
- Sladké (olovo a octan)
- Slaný (chlorid sodný)
- Kyselina (bitartrát draselný)
- Pikantné (glutaman sodný)
- Horká (síran horečnatý).
6. Oxid
Oxidové zlúčeniny obsahujú atómy kyslíka a ďalšie prvky. Vedeli ste, že väčšinu zemskej kôry tvoria oxidy? Tieto zlúčeniny vznikajú pri oxidácii prvkov kyslíkom. Oxidy majú tendenciu mať iónové štruktúry s vysokými bodmi varu.
7. Jazyk

Zlúčeniny, ktoré absorbujú hydróniové ióny (H3O), keď sa rozpustí vo vode. Zásada je duál kyseliny alebo chemického prvku, ktorý má pH vyššie ako 7. Vo všeobecnosti sa bázy delia na dva typy, a to slabé bázy a silné bázy. Závisí od jeho schopnosti uvoľňovať OH ióny.
Bázy majú niektoré spoločné vlastnosti, ktoré sú nasledovné:
- Má horkú chuť.
- Hladká základná štruktúra ako mydlo.
- Dokáže zmeniť farbu červeného lakmusu na modrú.
- Schopný viesť elektrický prúd.
- Dokáže neutralizovať kyseliny.
- Spôsobuje zvetrávanie.
- Hodnota pH presahuje číslo 7.
Čítať: Pevné
Príklady zlúčenín v každodennom živote

V každodennom živote sa živé veci nedajú oddeliť od zlúčenín. Okrem toho existuje toľko zlúčenín, ktoré ľudia konzumujú, aby prežili.
Nasledujú príklady zlúčenín, ktoré ľudia často používajú:
| Príklad zlúčeniny | Chemický vzorec |
| Oxid uhoľnatý plyn | CO |
| Oxid uhličitý plyn | CO2 |
| Plynný oxid dusnatý | NIE |
| Voda | H2O |
| Kuchynská soľ | Chlorid sodný / NaCl |
| Kyselina chlorovodíková | HCI |
| Kyselina sírová | H2SO4 |
| Kyselina octová (ocot) | CH3COOH |
| plynný amoniak | NH3 |
| Hydroxid sodný | NaOH |
| cukor | C12H22011 |
| Močovina | CO(NH2)2 |
| Alkohol | C2H3OH |
| Vápnik | CaCo3 |
Poznaním príkladov zlúčenín a ich typov. Teraz môžete lepšie pochopiť, aké zlúčeniny sú obsiahnuté v potravinách, nápojoch a predmetoch, ktoré sa používajú každý deň. Takže môžete byť opatrnejší aj pri výbere toho, čo budete konzumovať a používať.
X ZATVORENÉ
Reklamy
REKLAMA
X ZATVORENÉ
