Oxidačné čísla: Definícia, pravidlá stanovenia a príklady problémov
Oxidačné čísla: Definícia, pravidlá stanovenia a príklady problémov - Čo je oxidačné číslo a príklad? Pri tejto príležitosti O spoločnosti Knowledge.co.id bude o tom diskutovať a samozrejme o ďalších veciach, ktoré to tiež obklopujú.
Pozrime sa na diskusiu v článku nižšie, aby sme ju lepšie pochopili
Obsah
-
Oxidačné čísla: Definícia, pravidlá stanovenia a príklady problémov
- Pravidlá pre stanovenie oxidácie
- Príklady oxidačných čísel
- Zdieľaj toto:
- Súvisiace príspevky:
Oxidačné čísla: Definícia, pravidlá stanovenia a príklady problémov
Oxidačné číslo alebo oxidačný stav je počet negatívnych a pozitívnych nábojov v atóme, čo nepriamo označuje počet elektrónov, ktoré boli prijaté alebo odovzdané iným atómom. Niektoré atómy majú iba jeden oxidačný stav, ale niektoré atómy majú viac ako jeden oxidačný stav.
Ak nájdete hodnotu atómového čísla v molekule alebo zlúčenine, musíte najskôr poznať oxidačný stav atómov ďalších prvkov, ktoré majú všeobecné (štandardné) vlastnosti.
Pravidlá pre stanovenie oxidácie
Na stanovenie oxidačného čísla (Biloks) v ióne alebo iných zlúčeninách je potrebné dodržiavať nasledujúce pravidlá:
-
Oxidačný počet voľných prvkov vo forme atómov alebo molekúl prvkov je 0 (nula).
Voľné prvky vo forme atómov sú:
- Oxidačný stav C pri C je = 0
- Oxidačný stav Ca v Ca je = 0
- Oxidačný stav Cu na Cu je = 0
- Oxidačný stav Na v Na je = 0
- Oxidačný stav Fe v Fe je = 0
- Oxidačné číslo Al v Al je = 0
- Oxidačný stav Ne v Ne sa rovná 0
Voľné prvky vo forme molekúl sú:
- Oxidačný stav H H2 je = 0
- Oxidačný stav O v O2 je = 0
- Oxidačný stav Cl v Cl2 je = 0
- Oxidačný stav P v P4 je = 0
- Oxidačný stav S v S8 je = 0
-
Oxidačný stav kovu v zlúčenine je vždy pozitívny.
V skupine 1 kovové prvky (starý systém Gol. IA) (Li, Na, K, Rb, Cs, Fr), jeho oxidačný stav je +1.
- Oxidačný stav K v KCl, KNO3 alebo K2SO4 je = +1
V skupine 2 kovové prvky (stará systémová skupina. IIA) (Be, Mg, Ca, Sr, Ba, Ra), jeho oxidačný stav je +2.
- Oxidačný stav Mg v MgO, MgCl2 alebo MgS04 je = +2
Oxidačné čísla (Biloks) iných kovových prvkov sú:
- Hodnota Ag = +1
- Cu má hodnotu = +1 a +2
- Hodnota Hg je = +1 a +2
- Hodnota Au je = +1 a +3
- Fe má hodnotu = +2 a +3
-
Oxidačné číslo (Bilox) jednoatómových (pre 1 atóm) a viacatómových (viac ako 1 atóm) iónov je rovnaké v náboji iónov.
-
Oxidačné stavy monatomických iónov sú Na +, Ca2 +, Al3 +, Cl– a 02-, + 1, + 2, +3, -1 a -2.
- Oxidačné stavy polyatómových iónov sú NH4 +, SO42-, PO43-, respektíve +1, -2 a -3.
-
-
Oxidačný počet prvkov skupiny VIA (O, S, Se, Te, Po) v binárnych zlúčeninách je -2 a prvkov skupiny VIIA (F, Cl, Br, I, At) v binárnych zlúčeninách je -1.
-
Oxidačný stav prvku S v Na2S a MgS je = -2.
- Oxidačný stav prvku Cl v NaCI, KCl, MgCl2 a FeCl3 je = -1.
-
-
Oxidačné číslo prvku H v jeho zlúčeninách je = +1.
Okrem oxidačného stavu hydridov (zlúčeniny vodíka s kovmi) je hodnota = -1.
Pretože v hydridoch existuje vodík vo forme hydridového iónu H–. Oxidačný stav iónu, ako je hydrid, je rovnaký ako náboj na ióne, ktorý je = -1.
- Oxidačný stav prvku H v H20, HCl, H2S a NH3 je = +1.
- Oxidačný stav prvku H v NaH, CaH2 a AlH3 je = -1.
-
Oxidačné číslo prvku O v jeho zlúčenine je -2, okrem
-
Oxidačné číslo binárnej zlúčeniny v F je = +2.
- Oxidačný stav peroxidových zlúčenín, ako sú H2O2, Na2O2 a BaO2, je = -1.
- Oxidačný stav superoxidových zlúčenín, ako sú KO2 a NaO2, je = -½.
- Oxidačné číslo (Biloks) prvku O v H2O, KOH, H2SO4 a Na3PO4 je = -2
-
-
Súčet oxidačných čísel prvkov v zlúčenine je 0 (nula).
Súčet oxidačného počtu prvkov tvoriacich ióny alebo polyatómové zlúčeniny sa rovná náboju samotného polyatómového iónu.
-
Oxidačné číslo kyslíka (O) v peroxidovej zlúčenine = -1. Oxidačné číslo O v neperoxidových zlúčeninách = -2.
Príklad:
O oxidačný stav v BaO2 = -1.
Atóm Ba je kovový prvok skupiny IIA, takže oxidačný stav Ba = +2. Súčet oxidačných stavov Ba a O musí byť 0 (oxidačné pravidlo, bod 6). Preto musí byť oxidačný stav O -2. Pretože atóm O má index 2, tak oxidačný stav O: index O = -2: 2 = -1. Je dokázané, že oxidačný stav O v BaO2 je -1.
Príklady oxidačných čísel
Príklad Otázka 1
Stanovte oxidačné číslo prvkov tučným písmom v nasledujúcich zlúčeninách:
- N2O5
- MnO4–
- Al2(SO4)3
Odpoveď:
Stanoví sa oxidačný stav, napríklad x:
- 1. Poplatok N2O5 tj. (2 x oxidačný stav N) + (5 x oxidačný stav O)
0 = (2x (x)) + (5 x (-2))
0 = 2x - 10
x = +5
Takže oxidačné číslo atómu N v zlúčenine N2O5 je +5
- 2. Poplatok za MnO4– je (1 x oxidačné číslo Mn) + (4 x oxidačný stav O) nasledovne!
-1 je (1 x (x)) + (4 x (-2))
-1 je x - 8
x je +7
Takže oxidačné číslo atómu Mn v zlúčenine MnO je4– to je +7
- 3. Al zaťaženie2(SO4)3 = (2 x oxidačný stav Al) + (3 x oxidačný stav S) + (12 x oxidačný stav O), je:
0 = (2 x (+3)) + (3 x (x)) + (12 x (-2))
0 = 6 + 3x -24
x = +6
Takže oxidačné číslo atómu S v zlúčenine Al je2(SO4)3 to je +6.
Príklad Otázka 2
Okamžite pre príklad problému s oxidačnými číslami, v časti „Aké je oxidačné číslo atómu C v oxidačnom čísle v CH4 s pravidlom oxidačného čísla H = +1?
Odpoveď:
Oxx of H x Počet Atómov H = + '1 x 4 = +4
Oxx C x počet atómov C = a x 1 = a
Pri pohľade zo zlúčeniny je to neutrálna zlúčenina, potom počet oxidačných stavov prvkov v nej musí byť nulový, čo znamená:
a + (+4) = O
a = -4
Takže oxidačné číslo C v zlúčenine CH4 je -4.
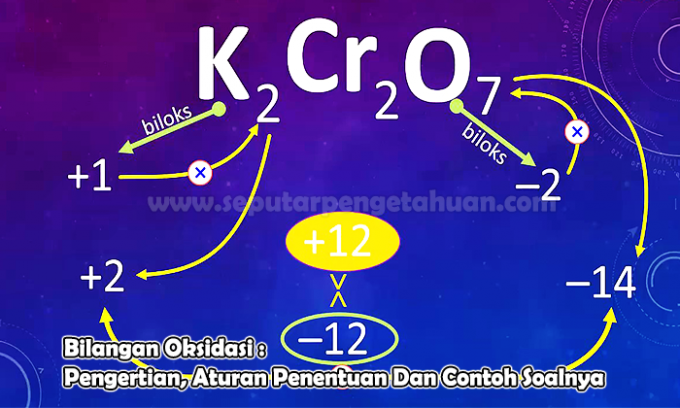
Príklad Otázka 3
Určte oxidačné číslo prvku N v nasledujúcich zlúčeninách:
N2O5
Odpoveď:
Oxidačný stav bude označený X
Poplatok N2O5 tj. (2 x oxidačný stav N) + (5 x oxidačný stav O)
0 = (2 x (x)) + (5 x (-2))
0 = 2x - 10
x = +5
Takže oxidačné číslo atómu N v zlúčenine N2O5 to je +5.
To je recenzia od O spoločnosti Knowledge.co.id o Oxidačné čísla: Definícia, pravidlá stanovenia a príklady problémov, Dúfajme, že to prispeje k vášmu pochopeniu a znalostiam. Ďakujeme za návštevu a nezabudnite si prečítať ďalšie články.
Prečítajte si tiež:BMKG: Definícia, história, pozícia a činnosti
