Definição Atômica de Rutherford, Teoria, Pontos Fortes e Desvantagens
Educação. Co. EU IA - Nesta ocasião, discutiremos a teoria atômica de retherford, uma explicação completa do átomo de retherford será descrita a seguir:
Compreendendo o Atom
Este átomo é uma unidade básica da matéria, que consiste em um núcleo atômico e uma nuvem de elétrons carregada negativamente que o envolverá. O núcleo deste átomo consiste em prótons carregados positivamente, ou nêutrons com carga neutra.
Os elétrons em um átomo podem ser ligados ao núcleo atômico por forças eletromagnéticas. De vários conjuntos de tais átomos também podem se relacionar entre si e também podem formar uma molécula. Os átomos contendo o mesmo número de prótons e elétrons são neutros, então aqueles que contêm Números diferentes de prótons ou elétrons são positivos ou negativos e costumam ser chamados de íons. Esses átomos também são agrupados com base no número de prótons e nêutrons contidos no núcleo atômico. O número de prótons no átomo determina o elemento químico do átomo, e o número de nêutrons determina o isótopo de um elemento específico.
Teoria Atômica de Ernerst Rutherford
Depois que a Teoria Atômica de John Dalton foi refutada e posteriormente corrigida por Jj. Thomson afirma que O átomo é como o Pão de Passa, então é a vez de Rutherford refutar a teoria atômica Thomsom.
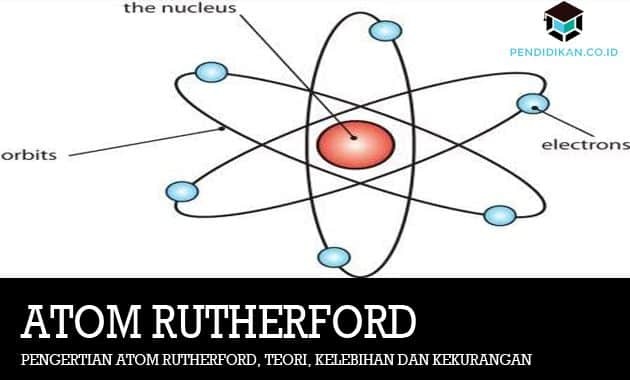
Naquela época, Rutherford disse que o átomo tinha um núcleo central ou freqüentemente chamado de núcleo rodeado por uma nuvem de elétrons com carga negativa.
A teoria atômica de Rutherford foi baseada no experimento de bombardear os núcleos atômicos das placas de ouro em partículas alfa, que é freqüentemente conhecido como o experimento Geiger-Marsden. Nessa pedra, Rutherford projetará um projeto experimental para o bombardeio de átomos de ouro por partículas alfa que foram partikel emitidos por elementos radioativos. Bem, ao que parece, existem raios radioativos que foram refletidos, desviados ou também encaminhado. Rutherford então explicou que quando a partícula alfa atinge o núcleo atômico, haverá uma colisão que causa a deflexão ou reflexão da partícula alfa. Isso se deve à massa e também à carga do átomo que se concentra no núcleo. Rutherford então sugeriu que a carga no núcleo atômico seria proporcional à massa atômica em unidades SMA / massa atômica. Partículas alfa que atingem a nuvem de elétrons não serão defletidas ou refletidas.
A partir dos resultados de sua compreensão por meio desses experimentos, Ernerst Rutherfordutherford finalmente concluiu e afirmou que:
- A maior parte do volume do átomo é um vácuo.
- A massa atômica ficará concentrada no núcleo atômico (núcleo).
- A carga atômica pode ser concentrada no centro do átomo com um volume bastante pequeno. O múltiplo da carga é proporcional à massa atômica.
Por meio de sua declaração E. Este Rutherford podia negar que o átomo não era como um pão de passas, mas também como um arranjo de planetas orbitando o sol. Ao qual o sol será comparado é como um núcleo central com carga positiva (núcleo) ou também um arranjo planetário que tem uma carga positiva é descrito como uma carga negativa, portanto, a teoria atômica de Dalton e Thomson tem suas vantagens ou desvantagens, Teoria atômica E. Rutherford também tem seus pontos fortes e fracos. Abaixo estão as vantagens e desvantagens da teoria atômica E. Rutherford.
Pontos Fortes e Desvantagens da Teoria Atômica de Ernerst Rutherford.
As vantagens e desvantagens da teoria atômica de Ernerst Rutherford são as seguintes:
Teoria Atômica de Ernerst Rutherford
- Fácil de entender para ser capaz de explicar a estrutura atômica muito complicada
- Pode explicar a forma da órbita de um elétron em torno do núcleo atômico
- Pode descrever o movimento dos elétrons ao redor do núcleo
Desvantagens da Teoria Atômica de Ernerst Rutherford
- O modelo atômico de Rutherford não foi capaz de explicar onde os elétrons estão localizados e também como eles giram em torno desses átomos.
- Esses elétrons podem emitir energia quando se movem, de modo que a energia atômica se torna instável.
- Não é possível explicar o espectro de linha no átomo de hidrogênio (H).
Isso é tudo e obrigado por ler sobre o Atomic Understanding, Theory, Strengths and Weaknesses de Rutherford. Esperançosamente, o que está descrito pode ser útil para você.
Veja tambémDefinição de campanha, elementos, tipos, formulários, funções, objetivos e mídia
Veja tambémDefinição de Empresa Holding, Características, Funções, Benefícios, Objetivos e Exemplos
Veja tambémDefinição Atômica de JJ Thomson, Teoria, Pontos Fortes e Desvantagens
