ZWIĄZKI: definicja, typy, przykłady
Ładowanie...
Nie zdając sobie z tego sprawy, ludzie często stykają się w życiu codziennym z różnego rodzaju związkami. Chociaż może nie wszyscy zdają sobie sprawę, a co dopiero rozumieją, co oznacza związek. W rzeczywistości istnieje wiele przykładów często występujących związków, takich jak sól, cukier, woda i tak dalej.
Ogólnie związki są klasyfikowane na kilka typów w oparciu o elementy składowe. Natomiast proces rozkładu związków odbywa się poprzez reakcję chemiczną. Rozróżnia również formę, konsystencję, smak i zapach każdego rodzaju związku.
Spis treści
Nazywanie wzorów złożonych
Związek to pojedyncza substancja, którą w wyniku reakcji chemicznej można podzielić na dwie lub więcej substancji. Przykładem związku często spotykanego w życiu codziennym jest woda. W procesie woda jest kombinacją pierwiastków tlenu (O) i wodoru (H) o wzorze chemicznym H20.
Raport z oficjalnej strony internetowej Ministerstwa Edukacji i Kultury Republiki Indonezji stwierdza, że najmniejszą częścią pierwiastka jest atom. Jeśli dwa atomy połączą się w reakcji chemicznej, utworzą cząsteczkę lub najmniejszą część związku.
Tymczasem proces tworzenia związków poprzez mieszanie chemiczne i rozkład termiczny lub elektryczny. Związki mają inne właściwości niż ich elementy składowe.
Na przykład właściwości wody różnią się od właściwości tworzących ją pierwiastków, a mianowicie tlenu i wodoru. Różnica w wyglądzie jest również bardzo realna. Ponieważ woda jest cieczą, wodór jest gazem. Ponadto woda może służyć do gaszenia pożarów.
Jednak wodór jest substancją łatwopalną. Natomiast tlen jest substancją potrzebną w procesie spalania. Widać więc, że elementy składowe i powstałe związki mają bardzo przeciwne właściwości, formy i funkcje.
Jaka jest więc różnica między związkiem a mieszaniną i pierwiastkiem? Chociaż związki i pierwiastki to pojedyncze substancje. Istnieją jednak różnice między związkami i pierwiastkami, a także mieszaninami.
Dzieje się tak, ponieważ pierwiastek jest pojedynczą substancją, której nie można przekształcić w prostsze substancje, a pierwiastek nadal zachowa swoje pierwotne właściwości lub cechy.
Przykładowe elementy:
- Złoto
- Prowadzić
- Żelazo
- Miedź
- Cynk
- Nikiel
Mieszanina to materiał składający się z dwóch lub więcej substancji, ale nadal ma właściwości substancji pierwotnej. Przykłady mieszanin obejmują:
- Powietrze
- woda rzeczna
- Głaz
- Mleko czekoladowe
- Sól jodowa
- Kawa
- Słodka herbata
Czytać: Płyn
Rodzaje związków
Przed dyskusją dalej o bezwzględnych przykładach związków w życiu codziennym. Dobrze, jeśli możesz również rozróżnić rodzaje związków.
Na podstawie elementów składowych związki są podzielone na kilka typów, a mianowicie:
1. Związek Organiczny

Pochodzi z żywych istot i procesu fotosyntezy. Związki organiczne zawierają węgiel pierwiastkowy (C) jako główny łańcuch. Ten rodzaj związku organicznego ma charakterystyczne właściwości nierozpuszczalności w wodzie i rozpuszcza się tylko po zmieszaniu z rozpuszczalnikami organicznymi.
Ponieważ powstaje z pierwiastka węgla (C), powoduje, że związki organiczne są bardziej łatwopalne. Przykładem związku organicznego jest cukier (C12H22011)
2. Związek nieorganiczny
Reklama

Ten rodzaj mieszanki pochodzi z surowców mineralnych. Związki nieorganiczne mają stosunkowo wyższą temperaturę wrzenia niż związki organiczne. Jednak związki nieorganiczne wydają się być niepalne i łatwo rozpuszczalne w wodzie. Na przykład dwutlenek krzemu (SiO2).
3. Kwaśny

Cząsteczki, które mogą oddawać jony wodorowe H+ i tworzy wiązanie kowalencyjne z kwasem Lewisa. W chemii związki kwasowe składają się z trzech definicji, a mianowicie Arrheniusa, Bronsteda-Lowry'ego i Lewisa.
Ogólnie kwasy mają następujące właściwości:
- Kwaśny po rozpuszczeniu w wodzie.
- Reaguje gwałtownie po zmieszaniu z metalami.
- Pieką w dotyku i może uszkodzić skórę.
- Mają pH poniżej 7.
- Kwasy to elektrolity, choć niekoniecznie jonowe.
- Może zamienić niebieski papierek lakmusowy w czerwony.
Kwasy mają różnorodne zastosowania, w tym usuwanie rdzy z metalowych przedmiotów poprzez wytrawianie lub wytrawianie. Ponadto kwas może być również stosowany jako elektrolit w akumulatorach z mokrymi ogniwami. Kwas siarkowy może być stosowany jako katalizator do produkcji benzyny.
Czytać: Kwas zasadowy
4. Związki jonowe

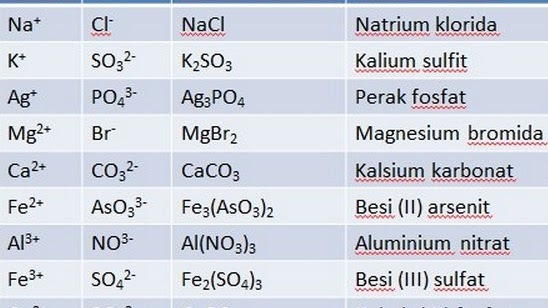
Termin ten odnosi się do związku chemicznego składającego się z jonów połączonych elektrostatycznie (wiązania jonowe). Chociaż związek ten jest ogólnie obojętny, składa się z jonów naładowanych dodatnio (kationów) i jonów naładowanych ujemnie (aniony), zarówno w postaci sodu, chlorku, jak i węglanu.
Właściwości związków jonowych:
- Ma bardzo wysoką temperaturę wrzenia przy niskiej prężności pary.
- Zasadowość lub podobieństwo do związków kwasowych.
- Większość rodzajów związków jonowych jest bardzo krucha.
- Ściśliwość związków jonowych zależy od struktury.
- Łatwo rozpuszczalny w cieczach polarnych, takich jak woda. Jednak wydaje się być trudny do rozpuszczenia w benzynie.
- Niska przewodność i generalnie nie przewodzą znacznej energii elektrycznej.
Związki jonowe mają różnorodne zastosowania i są powszechnie stosowane przez ludzi w życiu codziennym. Przykłady związków jonowych obejmują mleko magnezowe, boraks, wapno gaszone.
5. Sól

W chemii sól dzieli się na związki jonowe składające się z jonów ujemnych (aniony) i jonów dodatnich (kationów), tworząc w ten sposób związki bez ładunku lub obojętne. Sól powstaje w wyniku reakcji zasad i kwasów, takich jak chlorek, octan, fluorek, siarczan, do chlorku sodu.
Ze wszystkich rodzajów soli, które istnieją, każda sól ma inny smak, a mianowicie:
- Słodki (ołów i octan)
- Słony (chlorek sodu)
- Kwas (dwinian potasu)
- Cząber (glutaminian sodu)
- Gorzki (siarczan magnezu).
6. Tlenek
Związki tlenkowe zawierają atomy tlenu i innych pierwiastków. Czy wiesz, że większość skorupy ziemskiej składa się z tlenków? Związki te powstają, gdy pierwiastki utleniają się tlenem. Tlenki mają zwykle struktury jonowe o wysokich temperaturach wrzenia.
7. język

Związki absorbujące jony hydroniowe (H3O) po rozpuszczeniu w wodzie. Zasada to podwójna część kwasu lub pierwiastka chemicznego, która ma pH większe niż 7. Ogólnie zasady dzielą się na dwa typy, a mianowicie słabe zasady i mocne zasady. Zależy od jego zdolności do uwalniania jonów OH.
Bazy mają kilka wspólnych cech, które są następujące:
- Ma gorzki smak.
- Gładka konsystencja bazy jak mydło.
- Może zmienić kolor czerwonego lakmusa na niebieski.
- Potrafi przewodzić prąd elektryczny.
- Może neutralizować kwasy.
- Powoduje wietrzenie.
- Wartość pH przekracza liczbę 7.
Czytać: Solidny
Przykłady związków w życiu codziennym

W życiu codziennym żywych istot nie można oddzielić od związków. Co więcej, istnieje tak wiele związków, które ludzie spożywają, aby przeżyć.
Oto przykłady związków, które są często używane przez ludzi:
| Przykład złożony | Wzór chemiczny |
| Gazowy tlenek węgla | WSPÓŁ |
| Gazowy dwutlenek węgla | WSPÓŁ2 |
| Gazowy tlenek azotu | NIE |
| Woda | H2O |
| Sól kuchenna | Chlorek sodu / NaCl |
| Kwas chlorowodorowy | HCI |
| Kwas Siarkowy | H2WIĘC4 |
| Kwas octowy (ocet) | CH3COOH |
| Gaz amoniakalny | NH3 |
| Wodorotlenek sodu | NaOH |
| Cukier | C12H22011 |
| Mocznik | CO(NH2)2 |
| Alkohol | C2H3OH |
| Wapń | CaCo3 |
Znając przykłady związków i ich rodzaje. Teraz możesz lepiej zrozumieć, jakie związki znajdują się w żywności, napojach i przedmiotach używanych na co dzień. Możesz więc być bardziej ostrożny przy wyborze tego, co spożywać i używać.
X ZAMKNIJ
Reklamy
REKLAMA
X ZAMKNIJ
