Atomowa definicja, teoria, mocne i słabe strony Rutherforda
Edukacja. Współ. ID – Przy tej okazji omówimy teorię atomową retherforda, pełne wyjaśnienie atomu retherforda zostanie opisane w następujący sposób:
Zrozumienie atomu
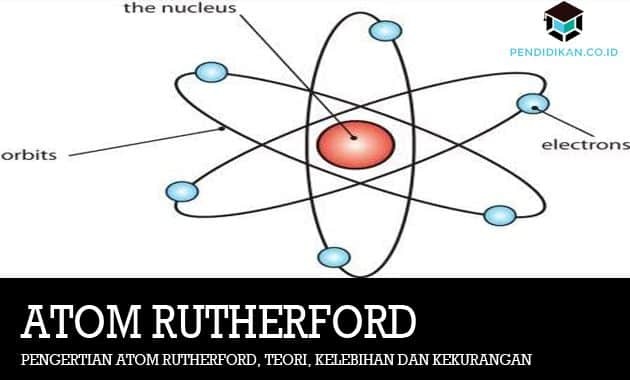
Atom ten jest podstawową jednostką materii, która składa się z jądra atomowego i otaczającej go ujemnie naładowanej chmury elektronowej. Jądro tego atomu składa się z dodatnio naładowanych protonów lub neutronów o ładunku obojętnym.
Elektrony w atomie mogą być związane z jądrem atomowym siłami elektromagnetycznymi. Z kilku zestawów takie atomy mogą również odnosić się do siebie, a także mogą tworzyć cząsteczkę. Atomy zawierające taką samą liczbę protonów i elektronów są obojętne, to te zawierające Różne liczby protonów lub elektronów są dodatnie lub ujemne i często są określane jako jony. Atomy te są również pogrupowane na podstawie liczby protonów i neutronów zawartych w jądrze atomowym. Liczba protonów w atomie określa pierwiastek chemiczny atomu, a liczba neutronów określa izotop danego pierwiastka.
Teoria atomowa Ernersta Rutherforda
Po tym, jak teoria atomowa Johna Daltona została odrzucona, a później poprawiona przez Jj. Thomson stwierdza, że Atom jest jak Chleb Rodzynkowy, potem kolej Rutherforda, by obalić teorię atomową Tomsom.
W tym czasie Rutherford powiedział, że atom ma centralne jądro lub często nazywane jądrem otoczonym chmurą elektronów o ładunku ujemnym.
Teoria atomowa Rutherforda opierała się na eksperymencie bombardowania jąder atomowych złotych płytek na cząstkach alfa, który jest często znany jako eksperyment Geigera-Marsdena. W tym kamieniu Rutherford zaprojektuje eksperymentalny projekt bombardowania atomów złota przez cząstki alfa, które zostały emitowane przez pierwiastki promieniotwórcze. Okazuje się, że istnieją promienie promieniotwórcze, które zostały odbite, odchylone, a także przekazane. Rutherford wyjaśnił następnie, że kiedy cząstka alfa uderzy w jądro atomowe, nastąpi zderzenie, które spowoduje ugięcie lub odbicie cząstki alfa. Wynika to z masy, a także ładunku atomu, który jest skoncentrowany w jądrze. Rutherford zasugerował następnie, że ładunek na jądrze atomowym byłby proporcjonalny do masy atomowej w jednostkach SMA/masy atomowej. Cząstki alfa uderzające w chmurę elektronów nie zostaną odbite ani odbite.
Na podstawie wyników jego zrozumienia poprzez te eksperymenty, Ernerst Rutherfordutherford w końcu wywnioskował i stwierdził, że:
- Większość objętości atomu to próżnia.
- Masa atomowa będzie skoncentrowana w jądrze atomowym (jądrze).
- Ładunek atomowy może być skoncentrowany w centrum atomu o dość małej objętości. Wielokrotność ładunku jest proporcjonalna do masy atomowej.
Za pomocą swojego oświadczenia E. Rutherford mógł zaprzeczyć, że atom nie przypomina chleba z rodzynkami, ale też układ planet krążących wokół Słońca. Słońce zostanie porównane jako dodatnio naładowany rdzeń centralny (jądro) lub układ planetarny, który ma ładunek dodatni jest opisywany jako ładunek ujemny, dlatego teoria atomowa Daltona i Thomsona ma swoje zalety lub wady, Teoria atomowa E. Rutherford ma również swoje mocne i słabe strony. Poniżej znajdują się zalety i wady teorii atomowej E. Rutherforda.
Mocne i wady teorii atomowej Ernersta Rutherforda.
Zalety i wady teorii atomowej Ernersta Rutherforda są następujące:
Teoria atomowa Ernersta Rutherforda
- Łatwy do zrozumienia, aby móc wyjaśnić bardzo skomplikowaną strukturę atomową
- Potrafi wyjaśnić kształt orbity elektronowej wokół jądra atomowego
- Potrafi opisać ruch elektronów wokół jądra
Wady teorii atomowej Ernersta Rutherforda
- Model atomowy Rutherforda nie był w stanie wyjaśnić, gdzie znajdują się elektrony i jak się obracają wokół tych atomów.
- Te elektrony mogą emitować energię, gdy się poruszają, więc energia atomowa staje się niestabilna.
- Nie potrafi wyjaśnić widma liniowego na atomie wodoru (H).
To wszystko i dziękuję za przeczytanie o Atomowym Zrozumieniu, Teorii, Mocnych i Słabościach Rutherforda. Mam nadzieję, że to, co zostało opisane, może być dla Ciebie przydatne.
Zobacz teżDefinicja kampanii, elementów, typów, formularzy, funkcji, celów i mediów
Zobacz teżDefinicja spółki holdingowej, cechy, funkcje, korzyści, cele i przykłady
Zobacz teżAtomowa definicja, teoria, mocne strony i wady JJ Thomsona
