Eksempel på et molalitetsproblem: Molfraksjon, formel og løsning
Eksempel på molalitetsproblem: Molfraksjon, formel og løsning – I denne anledning Om kunnskapen.co.id vil diskutere molalitet med flere eksempler på spørsmål og selvfølgelig om andre ting som også dekker det. La oss se på diskusjonen sammen i artikkelen nedenfor for å forstå den bedre.
Eksempel på et molalitetsproblem: Molfraksjon, formel og løsning
Molalitet eller molal konsentrasjon er et mål på konsentrasjonen av et oppløst stoff i en løsning når det gjelder mengden stoff i en viss masse av løsemidlet. Dette er forskjellig fra definisjonen av molaritet som er basert på et visst volum løsning.
Den vanlige enheten for molalitet i kjemi er mol/kg. En løsning med en konsentrasjon på 1 mol/kg uttrykkes også noen ganger som 1 molal. Begrepet molalitet er dannet i analogi med molaritet som er den molare konsentrasjonen av en løsning.
Molaliteten til en løsning kan testes ved å tilsette litt løsningsmiddel. Enklere er molaliteten (m) til en løsning molene oppløst stoff delt på kiloene løsemiddel. Molalitet eller molalitet er konsentrasjonen av en løsning som angir antall mol (n) oppløst stoff i 1 kg eller 1000 gram løsemiddel.
Forskjellen mellom molalitet og molaritet er at hvis molalitet er molalitet eller molal konsentrasjon (m) uttrykker antall mol løst stoff i 1000 gram løsemiddel mens molaritet er en angivelse av antall mol løst stoff i hver liter løsning. Molaritet er representert med notasjonen M og enhetene er mol/liter.
Molalitetsformel
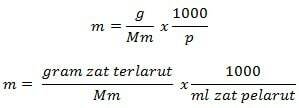
Informasjon
m = molalitet (mol/kg)
g = gram oppløst stoff (g)
Mm = molar masse av stoffet (g/mol)
P = masse av løsemiddel (g)
Molalitetsforhold med masseprosent
Masseprosent er en konsentrasjonsenhet som vanligvis brukes i kjemiske løsninger. Eksempler på løsninger som vi kan finne hver dag er 75 % alkoholløsning og 24 % eddiksyreløsning. Masseprosent er antall gram oppløst stoff i 100 gram løsningsmasse. Ligningen som viser beregningen av masseprosenten er som følger:

Forhold Molaritet Med Molaritet
Molaritet uttrykker antall mol oppløst stoff i en liter løsning. Molaritet kan konverteres til molalitet ved å konvertere volumet av løsningen til massen av løsningen. Konvertering av volum til masse krever data om tettheten til løsningen (p), som kan formuleres som følger:

Føflekkfraksjon
Molfraksjonen er et mål på konsentrasjonen av en løsning som uttrykker forholdet mellom antall mol i enkelte stoffer og det totale antallet mol som er tilstede i løsningens komponenter. Molfraksjonen er delt inn i 2 deler:
Molfraksjon av løst stoff (Xt)
Formelen for molfraksjonen av det oppløste stoffet (Xt), nemlig:

Informasjon:
Xt = molfraksjon av oppløst stoff
Nt = antall mol oppløst stoff
Np = antall mol løsemiddel
Løsemiddelmolfraksjon (Xp)
Formelen for molfraksjonen av løsningsmidlet (Xp), nemlig:

Informasjon
Xp = molfraksjon av løsemiddel
Nt = antall mol oppløst stoff
Np = antall mol løsemiddel
Summen av molfraksjonene av oppløst stoff og løsemiddel er 1
Xt + Xp = 1
Eksempler på molalitetsproblemer og løsninger
Oppgave 1
Hva er molaliteten til en løsning som inneholder 4 g NaOH (Ar Na = 23 g/mol, Ar O = 16 g/mol, og Ar H = 1 g/mol) oppløst i 250 g vann?
Fullføring:
Er kjent:
masse NaOH = 4 gr
ArNa = 23 gr/mol
ArO = 16 g/mol
ArH = 1 gr/mol
masse vann = 250 gr = 0,25 kg
Spurte: m = ?
Svar:
MR. NaOH = 40 gr/mol
antall mol NaOH = masse/Mr
antall mol NaOH = 4 gr/(40 gr/mol)
antall mol NaOH = 0,1 mol
m = antall mol/p
m = 0,1 mol / 0,25 kg
m = 0,4 m
Oppgave 2
Hva er molaliteten til en 37 % (vekt/vekt) HCl-løsning? (Ar H = 1 g/mol, Ar Cl = 35,5 g/mol)
Fullføring:
Er kjent:
masse HCl = 37 %
ArH = 1 g/mol
ArCl = 35,5 g/mol
Spurte: m = ?
Svar:
MR. HCl = 36,5 gr/mol
anta at massen til løsningen er 100 gram, så er massen av HCl:
HCl masse = 37 % x 100 gr
masse HCl = 37 gr
masse av løsningsmiddel = masse av løsning – masse av HCl
masse løsemiddel = 100 gr – 37 gr
masse løsemiddel = 63 gr = 0,063 kg
antall mol HCl = masse/Mr
antall mol HCl = 37 gr /(36,5 gr/mol)
antall mol HCl = 1,01 mol
m = antall mol/masse løsemiddel
m = 1,01 mol/0,063 kg
m = 16,03 m
Oppgave 3
Bestem molaliteten til løsningen fremstilt ved å løse 12 gram urea CO(NH2)2 i 250 gram vann.
Fullføring:
Er kjent:
masse urea = 12 gr
Mr Urea = 60 g/mol
masse løsemiddel = 250 gr = 0,25 kg
Spurte: m = ?
Annonse
Svar:
antall mol urea = masse/Mr
antall mol urea = 12 gr /(60 g/mol)
antall mol urea = 0,2 mol
m = antall mol/masse løsemiddel
m = 0,2 mol / 0,25 kg
m = 0,8 m
Oppgave 4
Hva er molaliteten til en alkoholløsning som inneholder 23 masseprosent etanol (Mr = 46)?
Svar:
Er kjent:
masse etanol = 23 %
Mr etanol = 46 g/mol
Spurte: m = ?
Fullføring:
for eksempel er massen av alkoholløsningen 100 gram, massen av etanol er:
masse etanol = 23 % x 100 gr
masse etanol = 23 gr
masse av løsningsmiddel = masse av løsning – masse av etanol
masse løsemiddel = 100 gr – 23 gr
masse løsemiddel = 77 gr = 0,077 kg
antall mol etanol = masse/Mr
antall mol etanol = 23 gr /(46 g/mol)
antall mol etanol = 0,5 mol
m = antall mol/masse løsemiddel
m = 0,5 mol/0,077 kg
m = 6,49 m
Oppgave 5
Beregn konsentrasjonen (masse%) av glukose i en 2 molal glukoseløsning.
Fullføring:
Er kjent:
m = 2 molal = 2 mol/kg = 0,002 mol/gr
Mr glukose = 180 gr/mol
Spurte: masse glukose (%) = ?
Svar:
mol glukose = masse/Mr
mol glukose = masse glukose/(180 g/mol)
mol glukose = masse glukose x 0,005 mol/gr
Bytt ut molene glukose i følgende ligning:
m = mol glukose/masse løsemiddel
0,002= masse glukose x 0,005/masse løsemiddel
o, oo2/o, oo5 = masse glukose/masse løsemiddel
2/5 = masse glukose/masse løsemiddel
Så masseforholdet glukose: masse av løsningsmiddel = 2:5, mens masseforholdet glukose: masse av løsning = 2:7.
Så,
% masse av glukose = (masse av glukose/masse av løsning) x100 %
% av massen av glukose = (2/7) x 100 %
% glukosemasse = 28,57 %
Oppgave 6
Hva er molaliteten til en løsning som inneholder 8 g NaOH (Ar Na = 23 g/mol, Ar O = 16 g/mol og Ar H = 1 g/mol) oppløst i 250 g vann?
Diskusjon
Er kjent:
Masse av NaOH = 8 gr
ArNa = 23 gr/mol
ArO = 16 g/mol
ArH = 1 gr/mol
masse vann = 250 gr = 0,25 kg
Søkes: Molalitet (m)???
Svar:
MR. NaOH = 40 gr/mol
Antall mol NaOH = masse/Mr
Antall mol NaOH = 8 gr/(40 gr/mol)
Antall mol NaOH = 0,2 mol
m = antall mol/p
m = 0,2 mol / 0,25 kg
m = 0,8 m
Oppgave 6
Bestem molaliteten til løsningen fremstilt ved å løse 15 gram urea CO(NH2)2 i 250 gram vann.
Diskusjon
Er kjent:
Masse urea = 15 gr
Mr Urea = 60 g/mol
Løsemiddelmasse = 250 gr = 0,25 kg
Ønskes: Molalitet (m)…. ?
Svar:
Antall mol urea = masse/Mr
Totalt mol urea = 15 gr / 60 g/mol
Antall mol urea = 0,25 mol
m = antall mol/masse løsemiddel
m = 0,25 mol / 0,25 kg
m = 1 m
Oppgave 7
Hva er molaliteten til en 37 % (vekt/vekt) HCl-løsning? (Ar H = 1 g/mol, Ar Cl = 35,5 g/mol).
Diskusjon
Er kjent:
masse HCl = 37 %
ArH = 1 g/mol
ArCl = 35,5 g/mol
Søkes: Molalitet (m)???
Svar:
MR. HCl = 36,5 gr/mol
Anta at massen til løsningen er 100 gram, så er massen av HCl:
HCl masse = 37 % x 100 gr
masse HCl = 37 gr
masse av løsningsmiddel = masse av løsning – masse av HCl
masse løsemiddel = 100 gr – 37 gr
masse løsemiddel = 63 gr = 0,063 kg
antall mol HCl = masse/Mr
antall mol HCl = 37 gr /(36,5 gr/mol)
antall mol HCl = 1,01 mol
m = antall mol/masse løsemiddel
m = 1,01 mol/0,063 kg
m = 16,03 m

Oppgave 8
Bestem mengden (gram) av NaOH som må løses opp i 1 liter vann (vann = 1,00 g/mL) for å oppnå 0,25 m NaOH.
Diskusjon
Er kjent:
1 L vann = 1000 mL = 1000 g (siden ρ vann = 1,00 g/mL)
mNaOH = 0,25 m
Mr NaOh = 40
Spurte: gr???
Svar:
mNaOH = gr / Mr x 1000 / P
0,25 = gr/40 x 1000/1000
0,25 = g/40
g = 0,25 x 40
g = 10 gram
Så mengden NaOH som trengs er 10 gram.
Oppgave 9
Bestem hvor mange ml vann som trengs for å løse opp 4,9 gram H2SO4 hvis konsentrasjon er 0,25 M (Ar H = 1; S = 32; O =16)!
Diskusjon
Er kjent:
mH2S04 = 0,25
Mr H2SO4 = 98
gr = 4,9 gram
spurte :p???
Svar:
m = gr/Mr x 1000/P
0,25 = 4,9/98 x 1000/p
p = 20 gram (20 ml)
Så volumet av vann er 20 ml.
Oppgave 10
Hvilken masse vann kreves for å lage en 1,2 m løsning med 0,6 mol NaCl?
Diskusjon
molalitet (m) = 1,2 mm =
nP
1,2 =
0,6P
P=
0,61,2
= 0,5 kg
Så massen av vann (masse av løsemiddel) som kreves er 0,5 kg
Oppgave 11
Anta at det er 2 mol oppløst stoff oppløst i 1 liter løsemiddel, hva er molaliteten?
Diskusjon
oppløste mol (n) = 2 molm =
nP
m =
21
= 2m
Beregn molaliteten til 25 gram KBr (Mr = 119) oppløst i 750 ml rent vann.
Diskusjon
oppløst stoff = 25 gram
Mr = 119
løsemiddel (P) = 750 mL = 750 gram (fordi ρ vann = 1,00 g/mL) = 0,75 kgn =
oppløst stoffMR
n =
25119
= 0,21 mol
m =
nP
m =
0,210,75
= 0,28 m
Dermed anmeldelsen fra Om kunnskapen.co.id Om Eksempel på et molalitetsproblem , forhåpentligvis kan bidra til din innsikt og kunnskap. Takk for besøket, og ikke glem å lese andre artikler.
Innholdsfortegnelse
Anbefaling:
- Cellulose er: definisjon, type, struktur, egenskaper og... Cellulose er: definisjon, type, struktur, egenskaper og funksjoner - Cellulose er en fiberlignende forbindelse, og finnes i de beskyttende celleveggene til planter. For å forstå bedre, vil vi selvfølgelig diskutere...
- √ Definisjon av utvidelse i lengde, formel, areal og volum av stoff... Definisjon av lang ekspansjon, formler, areal og volum av faste stoffer - I denne diskusjonen vil vi forklare om lang ekspansjon. Som inkluderer forestillingen om lang ekspansjon, lang ekspansjonsformler, areal, materievolum ...
- Mål: definisjon, lengdeenhetskonvertering, hvordan... Målestige: definisjon, konvertering av lengdeenheter, hvordan du bruker og eksempelspørsmål - hva er i hva mener du med størrelse stige og hvordan du bruker den?, denne gangen vil knowledge.co.id Diskuter det...
- Kovalente bindinger: definisjon, kjennetegn, typer, formler... Kovalente bindinger: definisjon, egenskaper, typer, kjemiske formler og egenskaper for forbindelser - Hva er en kovalent binding? I denne anledning vil Seputarknowledge.co.id diskutere det og selvfølgelig om andre ting også dekket det. La…
- Miljøtale: definisjon, formål, kjennetegn og... Miljøtale: Definisjon, formål, kjennetegn og eksempler - Hvordan er teksten i miljøtale strukturert? hva er bra og riktig?, I denne anledning vil Seputarknowledge.co.id diskutere det og selvfølgelig ting Hvilken…
- Kjegleformler, egenskaper, egenskaper, elementer og eksempler på problemer Kjegleformler, egenskaper, egenskaper, elementer og eksempler Problem - Hvordan beregne arealet og volumet til en form kjegleplass?, Ved denne anledningen vil Seputarknowledge.co.id diskutere det og selvfølgelig om andre ting Hvilken…
- Viskositetsformel: Definisjon av viskositet, koeffisient og... Viskositetsformel: Viskositetsdefinisjon, koeffisient og påvirkningsfaktorer - Hvordan er viskositetsformelen Viskositet er et mål på motstanden til en væske som endres enten ved stress eller av press. Ved denne anledningen, Seputarknowledge.co.id...
- Vektenhet: definisjon, konverteringsstige og eksempler... Vektenhet: definisjon, konverteringsstige og eksempelproblem - Hva er en vektenhet?, ved denne anledningen About the knowledge.co.id vil diskutere det, inkludert forståelse og selvfølgelig andre ting også dekket det. La…
- Treghetsøyeblikk: definisjon, faktorer, formlikninger... Treghetsmoment: definisjon, faktorer, ligninger i form av objekter og eksempelproblemer - hva menes med treghetsøyeblikket?, I denne anledning vil Se angående kunnskapen.co.id diskutere det og selvfølgelig om saken…
- Ensartet skiftende sirkulær bevegelse: definisjon, størrelse ... Ensartet skiftende sirkulær bevegelse: definisjon, fysisk mengde, formler og eksempler på problemer - hva er bevegelse Sirkulære endringer regelmessig og eksempler? Ved denne anledningen vil Seputarknowledge.co.id diskutere det og selvfølgelig om...
- Ubestemt integral: definisjon, formler, egenskaper og eksempler... Ubestemt integral: definisjon, formler, egenskaper og eksempler på problemer - Hva menes med ubestemt integral Selvfølgelig og hvordan beregne matematiske operasjoner? vil…
- Definisjon av læringsmetoder: kjennetegn, formål, typer og... Definisjon av læringsmetoder: kjennetegn, formål, typer og diskusjon - Hva menes med metode Læring?, I denne anledning vil Seputarknowledge.co.id diskutere det og selvfølgelig om andre ting Også…
- Kjemisk likevekt: Definisjon, lover, formler, eksempler på problemer Kjemisk likevekt: definisjon, lover, formler, eksempler på problemer - I denne diskusjonen vil vi forklare om kjemisk likevekt, formellov og utstyrt med eksempler på kjemisk likevekt med fullstendig og...
- Syre-base-løsninger: definisjon, syre-base-teori, egenskaper og... Syre-base-løsninger: Definisjon, syre-base-teori, egenskaper og typer - Syre- og baseløsninger er to grupper av kjemiske forbindelser som er mye funnet og brukt i hverdagen.
- Bygg plass – definisjon, formler og forskjellige... Bygg plass – definisjoner, formler og dets forskjellige typer – I denne anledningen ønsker vi å gjennomgå matematisk materiale om geometriske former, både når det gjelder forståelse og andre. Umiddelbart, la oss diskutere...
- √ Syre-base-indikator: Definisjon, typer og eksempler Syre-base-indikatorer: Definisjon, typer og eksempler - I denne anledning vil Around Knowledge diskutere syre-base-indikatorer. Som i denne diskusjonen forklarer betydningen av syreindikator ...
- Boyles lov: Definisjon, formler, applikasjoner og eksempler... Boyles lov: Definisjon, formler, anvendelser og eksempler på problemer - I denne diskusjonen vil vi forklare om Boyles lov. Som inkluderer betydningen av Boyles lov, Boyles lovformel, anvendelsen av ...
- Motiverende noveller: definisjon, skrivetips og eksempler Motiverende noveller: definisjon, skrivetips og eksempler - Hva er en motiverende novelle?, på Ved denne anledningen vil Seputarknowledge.co.id diskutere om det er novellen om vennskap og andre saker om det. La oss se…
- Definisjon av trykk: Typer trykk, formler og eksempler på problemer Definisjon av trykk: Typer trykk, formler og eksempler på problemer - Hva er trykk? I denne anledning, rundt kunnskapen.co.id, vil vi diskutere hva press er og hva andre elementer er dekket det. La oss se…
- Dynamiske væsker: typer, funksjoner, Bernoulli-ligning, teoremer... Dynamiske væsker: typer, egenskaper, Bernoullis ligning, Toricellis teorem, formler og eksempler på problemer – hva er det dynamiske væsker og deres typer? Om…
- Vanntetthet: definisjon, formler og eksempler Vanntetthet: Definisjon, formler og eksempler - Hva er tettheten til vann? La oss se sammen...
- Definisjon av mengde, enhet, mål og eksempler... Definisjon av mengde, enhet, mål og eksempler (fullstendig) - I grunnleggende fysikkbegreper har vi sikkert blitt introdusert for noe relatert til hverdagen. Som å måle høyde, veie masse, måle bredde,...
- Eksempler på vitenskapelig arbeid: funksjoner og språkregler Eksempler på vitenskapelige artikler: funksjoner og språkregler - Hva er eksempler på gode og riktige former for vitenskapelige artikler? Tidligere har Seputar the knowledge.co.id diskutert Scientific Work: Definition, Characteristics, Benefits,...
- Eksempler på flate former: Typer, kjennetegn og formler for flate former Eksempler på flate former: Typer, egenskaper og formler for flate former - Hva er eksemplene på flate former?
- Eksempler på kroppsøvingsspørsmål for klasse 11 (XI) SMA/MA/SMK semester 1 og 2 Eksempler på kroppsøvingsspørsmål for klasse 11 (XI) for SMA/MA/SMK semester 1 og 2 (2019 og 2020) - I denne anledning vil Seputarknowledge.co.id diskutere eksempler på kroppsøvingsspørsmål for klasse 11 Multiple Choice og Essay ...
- Nedbør er: 12 definisjoner i henhold til eksperter, typer,... Nedbør er: 12 definisjoner i henhold til eksperttyper og faktorer - I denne diskusjonen vil Around Knowledge forklare om nedbør. Nedbør er en klimatisk begivenhet som er naturlig,...
- √ Definisjon av kjemiske forbindelser, egenskaper, typer og nomenklatur... Definisjon av kjemiske forbindelser, egenskaper, typer, komplett nomenklatur - I denne diskusjonen vil vi forklare om kjemiske forbindelser. Dekker definisjonen, egenskapene, typene og nomenklaturen til kjemiske forbindelser med diskusjon...
- Enkeltstoffer er: Definisjon, elementer og forbindelser Enkeltstoffer er: definisjoner, grunnstoffer og forbindelser - Hva betyr et enkelt stoff? La oss se på diskusjonen sammen...
- Skråplan: definisjon, formler, mekaniske fordeler og... Skråplan: definisjon, formler, mekaniske fordeler og eksempler på problemer - Hva menes med fly skrå og hvordan beregne fysikken? naturlig…
- Enhetskonvertering: definisjon, faktor, lengde, masse, tid, … Enhetskonvertering: definisjon, faktor, lengde, masse, tid, volum og trykk - Hva er enhetskonvertering?, Ved denne anledningen vil Seputarknowledge.co.id diskutere det, inkludert faktorer, typer og selvfølgelig andre ting Hvilken…
