Oxidatiegetallen: definitie, bepalingsregels en voorbeeldproblemen
Oxidatiegetallen: definitie, bepalingsregels en voorbeeldproblemen – Wat is oxidatiegetal en een voorbeeld? In dit geval Over Knowledge.co.id zal het bespreken en natuurlijk over andere dingen die er ook mee te maken hebben.
Laten we de discussie in het onderstaande artikel eens bekijken om het beter te begrijpen
Inhoudsopgave
-
Oxidatiegetallen: definitie, bepalingsregels en voorbeeldproblemen
- Regels voor het bepalen van oxidatie
- Voorbeelden van oxidatiegetallen
- Deel dit:
- Gerelateerde berichten:
Oxidatiegetallen: definitie, bepalingsregels en voorbeeldproblemen
Oxidatiegetal of oxidatietoestand is het aantal negatieve en positieve ladingen in een atoom, wat indirect het aantal elektronen aangeeft dat is geaccepteerd of opgegeven aan andere atomen. Sommige atomen hebben slechts één oxidatietoestand, maar er zijn ook atomen die meer dan één oxidatietoestand hebben.
Als je de waarde van een atoomnummer in een molecuul of verbinding vindt, dan moet je eerst de oxidatietoestand kennen van de atomen van andere elementen die algemene (standaard) eigenschappen hebben.
Regels voor het bepalen van oxidatie
Om het oxidatiegetal (Biloks) in een ion of andere verbindingen te bepalen, moeten de onderstaande regels worden gevolgd:
-
Het oxidatiegetal van vrije elementen in de vorm van atomen of moleculen van elementen is 0 (nul).
De vrije elementen in de vorm van atomen zijn:
- De oxidatietoestand van C bij C is = 0
- De oxidatietoestand van Ca in Ca is = 0
- De oxidatietoestand van Cu op Cu is = 0
- De oxidatietoestand van Na in Na is = 0
- De oxidatietoestand van Fe in Fe is = 0
- Het oxidatiegetal van Al in Al is = 0
- De oxidatietoestand van Ne in Ne is gelijk aan 0
De vrije elementen in de vorm van moleculen zijn:
- De H oxidatietoestand van H2 is = 0
- De oxidatietoestand van O in O2 is = 0
- De oxidatietoestand van Cl in Cl2 is = 0
- De oxidatietoestand van P in P4 is = 0
- De oxidatietoestand van S in S8 is = 0
-
De oxidatietoestand van een metaal in een verbinding is altijd positief.
In de groep 1 metalen elementen (oud systeem Gol. IA) (Li, Na, K, Rb, Cs, Fr), De oxidatietoestand is +1.
- De oxidatietoestand van K in KCl, KNO3 of K2SO4 is = +1
In groep 2 metalen elementen (oude systeemgroep. IIA) (Be, Mg, Ca, Sr, Ba, Ra), de oxidatietoestand is +2.
- De oxidatietoestand van Mg in MgO, MgCl2 of MgSO4 is = +2
De oxidatiegetallen (Biloks) van andere metalen elementen zijn:
- Ag is de moeite waard = +1
- Cu is waard = +1 en +2
- Hg is de moeite waard = +1 en +2
- Au is de moeite waard = +1 en +3
- Fe is waard = +2 en +3
-
Het oxidatiegetal (Bilox) van monoatomaire (voor 1 atoom) en polyatomaire (meer dan 1 atoom) ionen is hetzelfde in de lading van de ionen.
-
De oxidatietoestanden van monoatomaire ionen zijn Na+, Ca2+, Al3+, Cl– en 02- respectievelijk +1,+2, +3, -1 en -2.
- De oxidatietoestanden van polyatomaire ionen zijn respectievelijk NH4+, SO42-, PO43-, respectievelijk +1, -2 en -3.
-
-
Het oxidatiegetal van groep VIA-elementen (O, S, Se, Te, Po) in binaire verbindingen is -2 en groep VIIA-elementen (F, Cl, Br, I, At) in binaire verbindingen is -1.
-
De oxidatietoestand van het element S in Na2S en MgS is = -2.
- De oxidatietoestand van het element Cl in NaCl, KCl, MgCl2 en FeCl3 is = -1.
-
-
Het oxidatiegetal van het element H in zijn verbindingen is = +1.
Behalve de oxidatietoestand van hydriden (waterstofverbindingen met metalen) is de waarde = -1.
Omdat in hydriden waterstof bestaat in de vorm van het hydride-ion, H–. De oxidatietoestand van een ion zoals een hydride is hetzelfde als de lading op een ion, namelijk = -1.
- De oxidatietoestand van het element H in H2O, HCl, H2S en NH3 is = +1.
- De oxidatietoestand van het element H in NaH, CaH2 en AlH3 is = -1.
-
Het oxidatiegetal van het element O in zijn verbinding is -2, behalve,
-
Het oxidatiegetal van een binaire verbinding in F is = +2.
- De oxidatietoestand van peroxideverbindingen, zoals H2O2, Na2O2 en BaO2, is = -1.
- De oxidatietoestand van superoxideverbindingen, zoals KO2 en NaO2, is = -½ .
- Het oxidatiegetal (Biloks) van element O in H2O, KOH, H2SO4 en Na3PO4 is = -2
-
-
De som van de oxidatiegetallen van de elementen in een verbinding is 0 (nul).
De som van een oxidatiegetal van elementen die ionen of polyatomaire verbindingen vormen, is gelijk aan de lading op het polyatomaire ion zelf.
-
Het oxidatiegetal van zuurstof (O) in de peroxideverbinding = -1. Oxidatiegetal van O in niet-peroxideverbindingen = -2.
Voorbeeld:
O oxidatietoestand in BaO2 = -1.
Het Ba-atoom is een metaalelement uit groep IIA, dus de oxidatietoestand van Ba = +2. De som van de oxidatietoestanden van Ba en O moet 0 zijn (de oxidatieregel punt 6). Daarom moet de oxidatietoestand van O -2 zijn. Omdat atoom O index 2 heeft, dus oxidatietoestand O: index O = -2: 2 = -1. Het is bewezen dat de oxidatietoestand van O in BaO2 is -1.
Voorbeelden van oxidatiegetallen
Voorbeeldvraag 1
Bepaal het oxidatiegetal van de vetgedrukte elementen in de volgende verbindingen:
- nee2O5
- MnO4–
- Al2(ZO4)3
Antwoord:
De oxidatietoestand wordt bepaald, bijvoorbeeld x:
- 1. Lading nr2O5 d.w.z. (2 x oxidatietoestand van N) + (5 x oxidatietoestand van O)
0 = (2x (x)) + (5x (-2))
0 = 2x – 10
x = +5
Het oxidatiegetal van het N-atoom in de verbinding N2O5 is dus +5
- 2. Lading van MnO4– is (1 x oxidatiegetal van Mn) + (4 x oxidatietoestand van O) als volgt!
-1 is (1 x (x)) + (4 x (-2))
-1 is x – 8
x is +7
Het oxidatiegetal van het Mn-atoom in de verbinding MnO is dus4– dat is +7
- 3. Al laden2(ZO4)3 = (2 x oxidatietoestand van Al) + (3 x oxidatietoestand van S) + (12 x oxidatietoestand van O), is:
0 = (2 x (+3)) + (3 x (x)) + (12 x (-2))
0 = 6 + 3x -24
x = +6
Het oxidatiegetal van het S-atoom in de verbinding Al is dus2(ZO4)3 dat is +6.
Voorbeeldvraag 2
Meteen voor het voorbeeldprobleem in oxidatiegetallen, dat in ' Wat is het oxidatiegetal van het C-atoom in het oxidatiegetal in CH4 met de oxidatiegetalregel H = +1 ?
Antwoord:
Oxx van H x aantal atomen H = + '1 x 4 = +4
Oxx C x Aantal Atomen C = a x 1 = a
Als gezien vanuit de verbinding een neutrale verbinding is, dan moet het aantal oxidatietoestanden van de elementen erin nul zijn, wat betekent:
a + (+4) = O
a = -4
Het oxidatiegetal van C in de verbinding CH4 is dus -4.
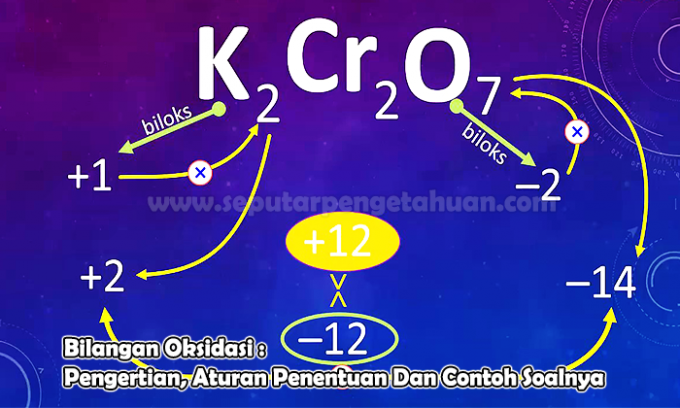
Voorbeeldvraag 3
Bepaal het oxidatiegetal van het element N in de volgende verbindingen:
nee2O5
Antwoord:
De oxidatietoestand wordt gemarkeerd met X
Lading nr2O5 d.w.z. (2 x oxidatietoestand van N) + (5 x oxidatietoestand van O)
0 = (2 x (x)) + (5 x (-2))
0 = 2x – 10
x = +5
Het oxidatiegetal van het N-atoom in de verbinding N. is dus2O5 dat is +5.
Dat is de recensie van Over Knowledge.co.id over Oxidatiegetallen: definitie, bepalingsregels en voorbeeldproblemen, Hopelijk kan het bijdragen aan uw inzicht en kennis. Bedankt voor uw bezoek en vergeet niet om andere artikelen te lezen.
Lees ook:BMKG: definitie, geschiedenis, positie en activiteiten
