화학량론 화학: 개념, 유형, 예제 문제
로드 중...
화학량론의 개념은 화학 반응에서 발생하는 반응물과 생성물의 양적 관계를 계산하기 위한 기초가 되는 화학 과학입니다. 반응 방정식과 기본 법칙을 기반으로 합니다.
화학량론적 반응의 특징은 반응물이나 반응이 모두 소모되었기 때문에 잔류물이 없다는 것입니다. 일반적으로 이 자료는 고등학교 10학년 때 가르쳤으며 다양한 학교 시험에서 종종 나옵니다. 다음은 전체 설명입니다.
내용 목록
화학량론적 화학 재료
화학량론을 공부한다는 것은 몇 가지 관련된 것들을 이해해야 한다는 것을 의미합니다. 이러한 것들 중 일부는 화학의 기본 법칙, 관련된 화학 개념 및 유형을 포함합니다. 이해력이 더 성숙해지도록 연습문제도 필요합니다.
화학량론을 위한 기본 화학 법칙
화학량론을 이해하기 위해 알아야 할 중요한 화학에는 다음과 같은 5가지 기본 법칙이 있습니다.
1. 질량 보존 법칙

1789년 라부아지에라는 화학자는 질량 보존 법칙을 공식화했습니다. 질량 보존 법칙의 본질은 화학 반응 전후에 물질이 소유한 총 중량이 동일하게 유지된다는 것입니다.
예를 들어, 태우기 전의 나무의 질량과 나무를 태운 결과의 질량은 변하지 않습니다. 즉, 반응이 일어나기 전과 후에 가지고 있는 물질이나 물체의 질량은 보존된다.
2. 고정 비교의 법칙

Joseph Proust는 1799년에 고정 비율의 법칙을 만든 전문가였습니다. 이 법칙은 특정 화합물을 구성하는 원소들의 총 중량 비율이 변하지 않거나 일정하게 유지된다는 것을 나타냅니다.
예를 들어, 용액에 포함된 물질 A와 물질 B의 질량 비는 항상 일정하며 용액의 부피에 전혀 영향을 받지 않습니다.
3. 다중 비교의 법칙

또한, 이해해야 할 화학량론의 기본 법칙은 1803년 John Dalton이 만든 배수비의 법칙입니다. 다중 비교는 상수 비교 법칙의 확장입니다.
배수 비율의 법칙은 2개의 원소가 2개 이상의 화합물을 형성할 때, 그들의 총 중량은 구성 요소 중 하나가 일정하면 다른 구성 요소의 총 가중치는 정수입니다. 단순한.
4. 게이 루삭의 법칙
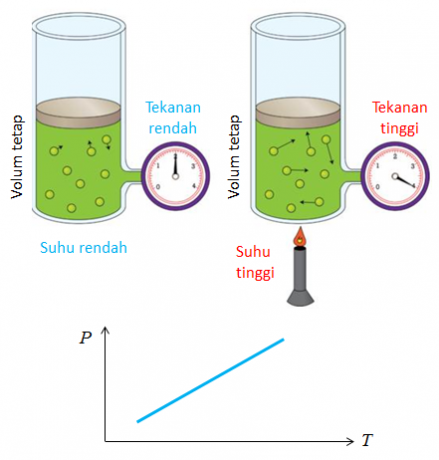
Joseph Gay Lussac이 발견한 법칙의 또 다른 이름은 부피비의 법칙입니다. 부피비교의 법칙에서 얻은 결론은 온도와 압력이 기체 부피의 변화에 영향을 미친다는 것입니다.
5. 아보가드로의 가설
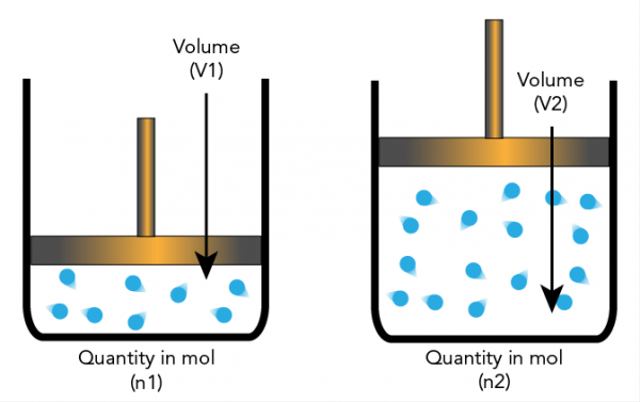
Amadeo Avogadro는 원소 입자가 항상 원자가 아니라 분자와 원소일 수 있다는 가설을 제시했습니다. 이것은 화학량론이 기반으로 하는 추가 설명으로 이어집니다.
아보가드로의 가설에 따르면 온도와 압력이 같으면 부피가 같은 기체의 비율은 같은 수의 분자를 갖게 됩니다.
읽다: 콜로이드 물질
화학량론에서 이해해야 할 화학 개념
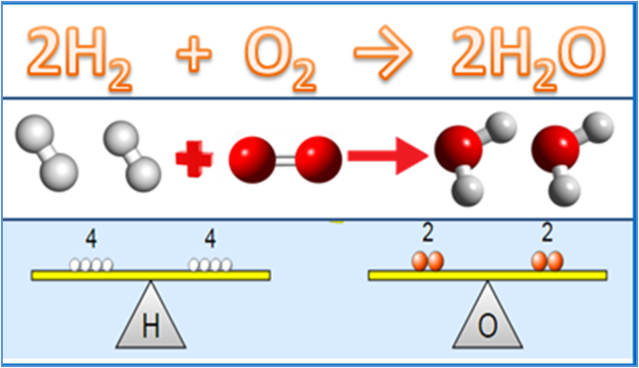
기본 법칙뿐만 아니라 화학양론적 물질과 밀접하게 관련된 다른 중요한 것은 화학의 개념입니다. 최소한 상대 원자 질량, 상대 분자 질량, 몰 농도 및 몰의 개념이라는 4가지 개념을 이해해야 합니다.
1. 상대 원자 질량(Ar)
화학에서 상대 원자 질량의 약어는 Ar입니다. 이 개념은 표준 원자 총량과 비교하여 결정되는 총 원자량을 나타냅니다. 순수 응용 화학 국제 연합(International Union of Pure and Applied Chemistry)은 탄소 원자를 결정 기준으로 사용합니다.
탄소 원자 또는 C-12 동위 원소는 다른 유형의 원자보다 더 불활성인 안정한 핵을 가지고 있기 때문에 선택되었습니다. 불활성은 발생하는 화학 반응에 대한 내성을 나타냅니다.
2. 상대분자량(Mr)
또한 Mr.로 약칭되는 상대 분자 질량의 개념이 있습니다. 화학량론의 개념 Mr는 원자 질량 단위를 사용하여 측정하는 분자의 총 중량입니다.
광고
이 개념에 따라 동일한 화합물을 가진 다른 분자는 포함하는 동위 원소가 다른 원소에서 왔기 때문에 분자 질량의 차이 가능성이 있습니다.
3. 몰 개념
화학에는 계산 과정을 단순화하는 계산 단위, 즉 두더지가 있습니다. 몰 개념은 분자, 원자 또는 이온의 수를 나타내는 아보가드로 수를 기반으로 합니다. 이 개념에 따르면 1몰은 6.022 x 10에 해당합니다.23 물질의 입자.
1몰의 질량은 그램 단위의 Ar 및 Mr에 해당한다고 말할 수 있습니다. 예를 들어, 탄소 12 g/mol의 몰 질량의 총 중량은 탄소 12 amu의 Ar과 같습니다.
4. 몰 농도
몰 농도는 1리터의 용매에 존재하는 용질의 몰 수를 나타내는 화학의 개념입니다. 즉, 몰농도는 단위 부피당 용질의 양이 갖는 농도를 나타냅니다.
읽다: 몰 농도 공식
화학량론의 종류

화학량론에는 반응, 기체 및 화합물 또는 조성의 3가지 유형이 있습니다. 전체 설명은 다음과 같습니다.
1. 반응 화학량론
반응 화학량론의 정의는 특정 화학 반응에 존재하는 물질 간의 양적 관계를 강조하는 개념 유형입니다. 이 개념은 발생하는 화학 방정식의 균형을 맞추는 데 사용됩니다.
이 설명을 바탕으로 화학 반응에 참여하는 물질은 이들 물질 간의 정량적 관계에 영향을 미친다고 말할 수 있습니다.
2. 기체 화학량론
다음으로, 기체 화학량론은 기체가 존재하는 화학 반응의 개념을 나타냅니다. 특정 압력, 온도 및 부피의 기체를 이상 기체로 간주합니다. 기체는 움직임이 무작위이고 상호 작용하지 않는 한 세트의 입자로 구성됩니다.
이상 기체 방정식은 P.V = n으로 표현됩니다. R.T. 공식에서 P는 기압 단위의 압력, V는 리터 단위 기체의 부피, n은 몰수, T는 273K의 온도, R은 기체 0.082L atm/mol K입니다.
3. 화합물 화학량론
화합물 또는 조성의 화학량론의 정의는 특정 화합물의 원소가 갖는 물질의 총 중량 또는 양의 양적 관계를 표현하는 개념입니다.
이 개념은 복합 암모니아를 형성하기 위해 결합된 수소와 질소의 총 중량을 설명하는 데 자주 사용됩니다.
읽다: 밀도 공식
화학량론 문제 및 토론의 예

화학량론과 관련된 문제를 해결하는 방법. 다음은 이해를 돕기 위한 질문과 토론의 예입니다.
1. 2몰의 H에 포함된 각 원자의 수를 구하십시오.2영형!
H2O는 2개의 H 원자와 1개의 O 원자를 가지고 있습니다. 그러면 솔루션은 다음과 같습니다.
H 원자의 수 = 2 2 mol 6.02. 1023 원자/몰 = 24.08. 1023 원자. 따라서 2몰의 H에 포함된 원자의 수는 24.08입니다. 1023.
이제 O 원자가 소유한 원자의 수를 세십시오. 즉:
O 원자의 수 = 1 2 mol 6.02. 1023 원자/몰 = 12.04. 1023 원자. 이러한 계산에 기초하여 2몰의 O에 있는 원자의 수는 12.04임을 알 수 있습니다. 1023.
2. 2몰의 C가 가지고 있는 총 중량 또는 질량을 계산하십시오.6시간12영형6 (포도당)! Ar C = 12, O = 16 및 H = 1의 합도 알려져 있습니다.
해결책:
질문에서 다음 정보를 볼 수 있습니다.
n = 2몰
씨씨6시간12영형6 = (6 Ar C) + (12 1) + (6 16)
= 180
다음으로 계산은 다음과 같습니다.
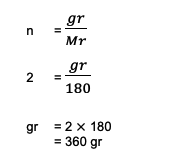
따라서 포도당 또는 C 2몰의 총 중량은6시간12영형6 이 계산에 따르면 최대 360g입니다.
화학에서 중요한 주제 중 하나는 화학 방정식과 화학식 사이의 양적 관계를 알아내기 위한 계산의 기본 개념인 화학량론입니다. 화학의 다른 몇 가지 개념도 화학량론과 관련이 있기 때문에 이해해야 합니다.
X 닫기
광고
광고
X 닫기
