酸化数:定義、決定規則、問題の例
酸化数:定義、決定規則、問題の例 –酸化数と例は何ですか? この機会に Knowledge.co.idについて それについて、そしてもちろんそれを取り巻く他のことについても話し合います。
それをよりよく理解するために、以下の記事の議論を見てみましょう
目次
-
酸化数:定義、決定規則、問題の例
- 酸化を決定するための規則
- 酸化数の例
- これを共有:
- 関連記事:
酸化数:定義、決定規則、問題の例
酸化数または酸化状態は、原子内の負電荷と正電荷の数であり、他の原子に受け入れられた、またはあきらめられた電子の数を間接的に示します。 一部の原子には1つの酸化状態しかありませんが、一部の原子には複数の酸化状態があります。
分子または化合物の原子番号の値を見つけた場合は、最初に、一般的な(標準の)特性を持つ他の元素の原子の酸化状態を知る必要があります。
酸化を決定するための規則
イオンまたは他の化合物の酸化数(Biloks)を決定するには、以下の規則に従う必要があります。
-
元素の原子または分子の形の遊離元素の酸化状態の値は0(ゼロ)です。
原子の形の自由元素は次のとおりです。
- CでのCの酸化状態は= 0です。
- Ca中のCaの酸化状態は= 0です。
- Cu上のCuの酸化状態は= 0です。
- Na中のNaの酸化状態は= 0です
- Fe中のFeの酸化状態は= 0です。
- Al中のAlの酸化数は= 0です
- Ne中のNeの酸化状態は0に等しい
分子の形の遊離元素は次のとおりです。
- H2のH酸化状態は= 0です
- O2中のOの酸化状態は= 0です。
- Cl2中のClの酸化状態は= 0です。
- P4のPの酸化状態は= 0です。
- S8のSの酸化状態は= 0です。
-
化合物中の金属の酸化状態は常に正です。
グループ1の金属元素(旧システムGol。 IA)(Li、Na、K、Rb、Cs、Fr)、その酸化状態は+1です。
- KCl、KNO3、またはK2SO4のKの酸化状態は= +1です。
グループ2の金属元素(古いシステムグループ)。 IIA)(Be、Mg、Ca、Sr、Ba、Ra)、その酸化状態は+2です。
- MgO、MgCl2、またはMgSO4中のMgの酸化状態は= + 2です。
他の金属元素の酸化数(Biloks)は次のとおりです。
- Agは価値がある= + 1
- Cuの価値= + 1および+2
- Hgは= + 1と+2の価値があります
- Auは= + 1と+3の価値があります
- Feの価値= + 2および+3
-
単原子(1原子の場合)イオンと多原子(1原子以上)イオンの酸化数(ビロクシ)は、イオンの電荷で同じです。
-
単原子イオンの酸化状態は、それぞれNa +、Ca2 +、Al3 +、Cl–、および02-であり、それぞれ+ 1、+ 2、+ 3、-1、および-2です。
- 多原子イオンの酸化状態は、それぞれNH4 +、SO42-、PO43-、+ 1、-2、および-3です。
-
-
二元化合物のVIA族元素(O、S、Se、Te、Po)の酸化数は-2であり、二元化合物のVIIA族元素(F、Cl、Br、I、At)は-1です。
-
Na2SおよびMgS中の元素Sの酸化状態は= -2です。
- NaCl、KCl、MgCl2、およびFeCl3中の元素Clの酸化状態は= -1です。
-
-
その化合物中の元素Hの酸化数は= + 1です。
水素化物(金属を含む水素化合物)の酸化状態を除いて、値= -1です。
水素化物では、水素は水素化物イオンH–の形で存在するためです。 水素化物などのイオンの酸化状態は、イオンの電荷と同じ= -1です。
- H2O、HCl、H2S、およびNH3における元素Hの酸化状態は= + 1です。
- NaH、CaH2、およびAlH3の元素Hの酸化状態は= -1です。
-
その化合物中の元素Oの酸化数は-2です。
-
Fの二元化合物の酸化数は= + 2です。
- H2O2、Na2O2、BaO2などの過酸化物化合物の酸化状態は= -1です。
- KO2やNaO2などのスーパーオキシド化合物の酸化状態は=-½です。
- H2O、KOH、H2SO4およびNa3PO4の元素Oの酸化数(Biloks)は= -2です。
-
-
化合物の元素の酸化数の合計は0(ゼロ)です。
イオンまたは多原子化合物を形成する元素の酸化数の合計は、多原子イオン自体の電荷に等しくなります。
-
過酸化物化合物の酸素(O)の酸化数= -1。 非過酸化物化合物中のOの酸化数= -2。
例:
BaOのO酸化状態2 = -1.
Ba原子はIIA族の金属元素であるため、Baの酸化状態は+2です。 BaとOの酸化状態の合計は0でなければなりません(酸化ルールポイント6)。 したがって、Oの酸化状態は-2でなければなりません。 原子Oはインデックス2を持っているので、酸化状態O:インデックスO = -2:2 = -1です。 BaO中のOの酸化状態が証明されている2 -1です。
酸化数の例
質問例1
次の化合物の太字の元素の酸化数を決定します。
- N2O5
- MnO4–
- アル2(そう4)3
回答:
酸化状態が決定されます。たとえば、x:
- 1. チャージN2O5 つまり、(Nの2 x酸化状態)+(Oの5 x酸化状態)
0 =(2x(x))+(5 x(-2))
0 = 2x – 10
x = +5
したがって、化合物N2O5のN原子の酸化数は+5です。
- 2.MnOの充電4– (1 x Mnの酸化数)+(4 x Oの酸化状態)は次のようになります!
-1は(1 x(x))+(4 x(-2))
-1はx– 8
xは+7です
したがって、化合物MnOのMn原子の酸化数は次のようになります。4– つまり+7
- 3. アルロード2(そう4)3 =(Alの2 x酸化状態)+(Sの3 x酸化状態)+(Oの12 x酸化状態)は次のとおりです。
0 =(2 x(+3))+(3 x(x))+(12 x(-2))
0 = 6 + 3x -24
x = +6
したがって、化合物AlのS原子の酸化数は次のようになります。2(そう4)3 つまり+6です。
質問2の例
酸化数の問題の例の直後に、 '酸化数規則H = +1のCH4の酸化数のC原子の酸化数は何ですか?
回答:
HのOxxx原子の数H = + '1 x 4 = +4
Oxx Cx原子数C = a x 1 = a
化合物から見て中性化合物である場合、その中の元素の酸化状態の数はゼロでなければなりません。つまり、次のことを意味します。
a +(+ 4)= O
a = -4
したがって、化合物CH4のCの酸化数は-4です。
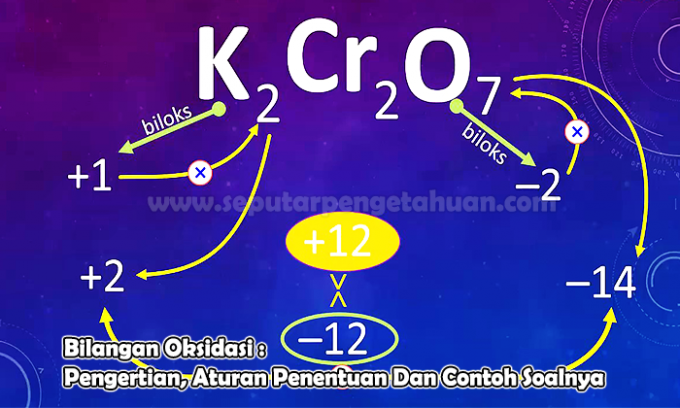
質問例3
次の化合物の元素Nの酸化数を決定します。
N2O5
回答:
酸化状態はXでマークされます
チャージN2O5 つまり、(Nの2 x酸化状態)+(Oの5 x酸化状態)
0 =(2 x(x))+(5 x(-2))
0 = 2x – 10
x = +5
したがって、化合物NのN原子の酸化数は次のようになります。2O5 つまり+5です。
それはからのレビューです Knowledge.co.idについて 約 酸化数:定義、決定規則、問題の例, うまくいけば、それはあなたの洞察と知識に追加することができます。 ご覧いただきありがとうございます。他の記事もお読みください。
また読む:BMKG:定義、歴史、立場、活動
