モル濃度、式、調製、溶液および例の希釈を理解する
モル濃度、式、調製、溶液および例の希釈を理解する –このディスカッションでは、モル濃度の意味について説明します。 これには、モル濃度、モル濃度式、モル濃度問題の例、溶液の調製と希釈の理解が含まれ、これらは完全かつ軽く議論されています。 詳細については、以下のレビューを注意深くお読みください。
目次
-
モル濃度、式、調製、溶液および例の希釈を理解する
- モル濃度とモル濃度式を理解する
- ソリューション作成
- 溶液の希釈
- モル濃度問題の例
- これを共有:
- 関連記事:
モル濃度、式、調製、溶液および例の希釈を理解する
モル濃度について慎重に話し合いましょう。
モル濃度とモル濃度式を理解する
濃度は、溶媒の量または特定の量の溶液に対して存在する溶質の量です。 この場合、溶媒は液体の形であるのに対し、物質は液体または固体の状態にあると想定できます。 濃度はさまざまな方法で説明できますが、そのうちの1つが一般的に使用されています。実際、今日使用するのはモル濃度(M)またはモル濃度です。 モル濃度は、溶液1リットルあたりに溶解したモル数です。 または、次の式を使用して説明できます。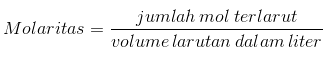
また、次の式で表すこともできます。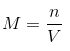 ここで、nは溶解したモル数、Vは各リットルの溶液の体積です。 既知のものがモルではなく溶質のグラムである場合、上記の式は次のように表すこともできます。
ここで、nは溶解したモル数、Vは各リットルの溶液の体積です。 既知のものがモルではなく溶質のグラムである場合、上記の式は次のように表すこともできます。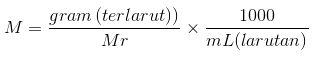
もう1つ、既知のことが溶液の密度(ρ)と濃度または質量パーセント(%)である場合、モル濃度は例のような式を使用して求めることができます。
1.46モルのグルコース溶液(C6H12O6)は1.46 MCと書かれています6H12O6、これは、1.46モルの溶質(C6H12O6)1リットルの溶液に。 この場合、容量は1リットルである必要はありません。重要なことは、比率が同じであることです。 たとえば、溶液の量が500 mL(0.5L)の場合、C6H12O6 溶解は0.73モルです。
また読む:肩甲骨:定義、機能、動き、付着した筋肉および障害
ソリューション作成
もちろん、モル濃度に直接関係する解決策を作る際に。 したがって、最初のステップは、事前に計量された溶質(通常はグラム単位の質量を持つ固体)を漏斗付きのメスフラスコに入れることです。 次のステップは、メスフラスコに少量の水をゆっくりと加えて、溶質が振とうして溶解するようにすることです。
次に、溶解した物質が完全に溶解したら、次のステップは水を少しずつ加え、メスフラスコの境界線を越えないようにすることです。
メスフラスコに入れられる溶液の量を知り、溶質の量も知ることによって(しばしば測定されます)。 後でそれを式mol = gram / Mr)で1モルに変換できるように、溶液のモル濃度が計算されます。 それ。
溶液の希釈
通常、溶液は「ストック」溶液として高濃度で調製され、実験室に保管されます。 これにより、各実習で解決策を作成する必要がある場合と比較して、時間が短縮されます。 この「ストック」溶液は少量しか摂取せず、必要に応じて濃度が低くなるように希釈します。 したがって、溶液を希釈する方法を知る必要があります。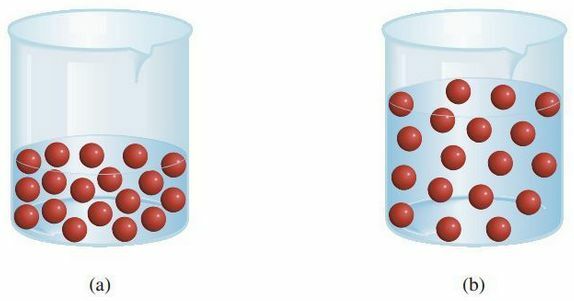
希釈を行っても、実際の溶質のモル数は変化せず、体積だけが変化します。 次の図の説明に従ってください
希釈する前に18個の溶解分子がある場合、水を加えても溶解分子の数は変わりませんよね? それはまだ18分子になります。 モル数も同様に変化しないので、適用できます。
n 希釈前= n 小売後
そして、前のモル濃度式(n = M.V)によれば、次のようになります。
また読む:染色体、構造、タイプ、形状、および数の定義
n1 = n2
M1 V1 = M2 V2
Mはどこですか1 すなわち、希釈前の初期濃度とM2 は希釈後の溶液の濃度です。
モル濃度問題の例
以下は、モル濃度の適用による問題の例です。
1.溶液Hの体積はどれくらいですか2そう4 200 mLHの溶液を作るには2Mが必要です2そう4 0.5M?
回答:
M1 = 2M、V1 = …?
M2 = 0.5 M、V2 = 200 mL
次に:
M1.V1 = M2.V2
2.V1 = 0,5.200
V1 = 50 mL
したがって、それはについて説明されています モル濃度、式、調製、溶液および例の希釈を理解する、うまくいけば、あなたの洞察と知識に追加することができます。 ご覧いただきありがとうございます。他の記事もお読みください。

