モル分率の問題の例:モル分率、式、および解決策
モル濃度の例の問題:モル分率、式、および解決策– この機会に Knowledge.co.idについて 問題のいくつかの例で、そしてもちろんそれをカバーする他の事柄について、モル濃度について議論します。 それをよりよく理解するために、以下の記事の議論を見てみましょう。
目次
-
モル分率の問題の例:モル分率、式、および解
- モル濃度式
- 質量パーセントとのモル濃度の関係
- モル濃度とモル濃度の関係
-
モル派
- 溶質のモル分率(Xt)
- 溶媒のモル分率(Xp)
- モル濃度の問題と解決策の例
- これを共有:
- 関連記事:
モル分率の問題の例:モル分率、式、および解
モル濃度またはモル濃度は、特定の溶媒質量中の物質量に関する溶液中の溶質の濃度の尺度です。 これは、一定量の溶液に基づくモル濃度の定義とは異なります。
化学における一般的なモル濃度の単位はmoles / kgです。 1 mol / kgの濃度の溶液は、1molalと表されることもあります。 モル濃度という用語は、溶液のモル濃度であるモル濃度と同様に形成されます。
溶液のモル濃度は、溶媒を加えることでテストできます。 より簡単に言えば、溶液のモル濃度(m)は、溶質のモル数を溶媒のキログラムで割ったものです。 モル濃度またはモル濃度は、1kgまたは1000グラムの溶媒中の溶質のモル数(n)を示す溶液の濃度です。
モル濃度とモル濃度の違いは、モル濃度がモル濃度であるか、モル濃度(m)がモル数を表すかです。 モル濃度は1リットルあたりの溶質のモル数のステートメントであるのに対し、1000グラムの溶媒中の溶質 解決。 モル濃度は表記Mで表され、単位はモル/リットルです。
モル濃度式
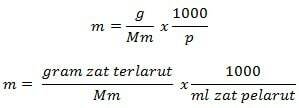
情報
m =モル濃度(mol / kg)
g =溶質のグラム(g)
Mm =物質のモル質量(g / mol)
P =溶媒の質量(g)
質量パーセントとのモル濃度の関係
質量パーセントは、化学溶液で一般的に使用される濃度の単位です。 たとえば、私たちが毎日見つけることができる解決策は、75%のアルコール溶液と24%の酢溶液です。 質量パーセントは、100グラムの溶液中の溶質のグラム数を質量で表したものです。 質量パーセントの計算を示す式は次のとおりです。
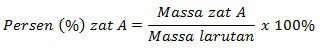
モル濃度とモル濃度の関係
モル濃度は、1リットルの溶液中の溶質のモル数を示します。 溶液の体積を溶液の質量に変えることにより、モル濃度をモル濃度に変換することができます。 体積を質量に変換するには、溶液の密度(p)に関するデータが必要です。これは、次のように定式化できます。
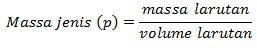
モル派
モル分率は、成分溶液に存在する総モル数に対する物質のモル数の比率を表す溶液の濃度の尺度です。 モル分率は2つの部分に分けられます:
溶質のモル分率(Xt)
溶質のモル分率(Xt)の式は次のとおりです。
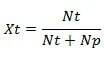
情報:
Xt =溶質のモル分率
Nt =溶質のモル数
Np =溶媒のモル数
溶媒のモル分率(Xp)
溶媒のモル分率(Xp)の式は次のとおりです。
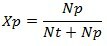
情報
Xp =溶媒のモル分率
Nt =溶質のモル数
Np =溶媒のモル数
溶質と溶媒のモル分率の合計は1です。
Xt + Xp = 1
モル濃度の問題と解決策の例
問題1
また読む:グランドフォレストパークの定義、目的と基準(完全)
250gの水に溶解した4gのNaOH(Ar Na = 23 g / mol、Ar O = 16 g / mol、およびAr H = 1 g / mol)を含む溶液のモル濃度はどれくらいですか?
解決:
知られている:
NaOHの質量= 4 gr
Ar Na = 23 g / mol
ArO = 16 g / mol
Ar H = 1 g / mol
水の質量= 250 gr = 0.25 kg
質問:m =?
回答:
氏。 NaOH = 40 gr / mol
NaOHのモル数=質量/ Mr
NaOHのモル数= 4 gr /(40 gr / mol)
NaOHのモル数= 0.1 mol
m =モル数/ p
m = 0.1 mol /0.25 kg
m = 0.4 m
問題2
37%(w / w)HCl溶液のモル濃度はどれくらいですか? (Ar H = 1 g / mol、Ar Cl = 35.5 g / mol)
解決:
知られている:
HClの質量= 37%
Ar H = 1 g / mol
Ar Cl = 35.5 g / mol
質問:m =?
回答:
氏。 HCl = 36.5 g / mol
たとえば、溶液の質量が100 gの場合、HClの質量は次のようになります。
HClの質量= 37%x 100 gr
HClの質量= 37 gr
溶媒の質量=溶液の質量–HClの質量
溶剤の質量= 100 gr – 37 gr
溶媒の質量= 63 gr = 0.063 kg
HClのモル数=質量/ Mr
HClのモル数= 37 gr /(36.5 gr / mol)
HClのモル数= 1.01 mol
m =溶媒のモル数/質量
m = 1.01 mol /0.063 kg
m = 16.03 m
問題3
12グラムの尿素CO(NH2)2を250グラムの水に溶解して調製した溶液のモル濃度を測定します。
解決:
知られている:
尿素の質量= 12 gr
尿素氏= 60 g / mol
溶媒の質量= 250 gr = 0.25 kg
質問:m =?
広告
回答:
尿素のモル数=質量/ Mr
尿素のモル数= 12 gr /(60 g / mol)
尿素のモル数= 0.2 mol
m =溶媒のモル数/質量
m = 0.2 mol /0.25 kg
m = 0.8 m
質問4
23質量%のエタノールを含むアルコール溶液のモル濃度はどれくらいですか(Mr = 46)?
回答:
知られている:
エタノールの質量= 23%
エタノール氏= 46 g / mol
質問:m =?
解決:
たとえば、アルコール溶液の質量が100 gの場合、エタノールの質量は次のようになります。
エタノールの質量= 23%x 100 gr
エタノールの質量= 23 gr
溶媒の質量=溶液の質量–エタノールの質量
溶剤の質量= 100 gr – 23 gr
溶媒の質量= 77 gr = 0.077 kg
エタノールのモル数=質量/ Mr
エタノールのモル数= 23 gr /(46 g / mol)
エタノールのモル数= 0.5 mol
m =溶媒のモル数/質量
m = 0.5 mol /0.077 kg
m = 6.49 m
質問5
2モルのグルコース溶液中のグルコースの濃度(質量%)を計算します。
解決:
知られている:
m = 2モル= 2 mol / kg = 0.002 mol / gr
Mrグルコース= 180 g / mol
質問: ブドウ糖の質量(%)=?
回答:
ブドウ糖のモル=質量/ Mr
ブドウ糖のモル=ブドウ糖の質量/(180g / mol)
ブドウ糖のモル=ブドウ糖の質量x0.005 mol / gr
ブドウ糖のモルを次の方程式に代入します。
m =グルコースのモル/溶媒の質量
0.002 =グルコースの質量x0.005 /溶媒の質量
o、oo2 / o、oo5 =グルコースの質量/溶媒の質量
2/5 =グルコースの質量/溶媒の質量
したがって、グルコースの質量:溶媒の質量の比率= 2:5であるのに対し、グルコースの質量:溶液の質量の比率= 2:7です。
次に、
%グルコースの質量=(グルコースの質量/溶液の質量)x100%
グルコースの%質量=(2/7)x 100%
%グルコース質量= 28.57%
質問6
250gの水に溶解した8gのNaOH(Ar Na = 23 g / mol、Ar O = 16 g / mol、およびAr H = 1 g / mol)を含む溶液のモル濃度はどれくらいですか?
討論
知られている:
NaOHの質量= 8 gr
Ar Na = 23 g / mol
ArO = 16 g / mol
Ar H = 1 g / mol
水の質量= 250 gr = 0.25 kg
質問:モル濃度(m)…。?
回答:
氏。 NaOH = 40 gr / mol
NaOHのモル数=質量/ Mr
NaOHのモル数= 8 gr /(40 gr / mol)
NaOHのモル数= 0.2 mol
また読む:はしご:定義、長さの単位の変換、使用方法、問題の例
m =モル数/ p
m = 0.2 mol /0.25 kg
m = 0.8 m
質問6
15グラムの尿素CO(NH2)2を250グラムの水に溶解して調製した溶液のモル濃度を測定します。
討論
知られている:
尿素の質量= 15 gr
尿素氏= 60 g / mol
溶媒の質量= 250 gr = 0.25 kg
募集:モル濃度(m)…。 ?
回答:
尿素のモル数=質量/ Mr
尿素のモル数= 15 gr / 60 g / mol
尿素のモル数= 0.25 mol
m =溶媒のモル数/質量
m = 0.25 mol /0.25 kg
m = 1 m
質問7
37%(w / w)HCl溶液のモル濃度はどれくらいですか? (Ar H = 1 g / mol、Ar Cl = 35.5 g / mol)。
討論
知られている:
HClの質量= 37%
Ar H = 1 g / mol
Ar Cl = 35.5 g / mol
質問:モル濃度(m)…?
回答:
氏。 HCl = 36.5 g / mol
たとえば、溶液の質量が100 gの場合、HClの質量は次のようになります。
HClの質量= 37%x 100 gr
HClの質量= 37 gr
溶媒の質量=溶液の質量–HClの質量
溶剤の質量= 100 gr – 37 gr
溶媒の質量= 63 gr = 0.063 kg
HClのモル数=質量/ Mr
HClのモル数= 37 gr /(36.5 gr / mol)
HClのモル数= 1.01 mol
m =溶媒のモル数/質量
m = 1.01 mol /0.063 kg
m = 16.03 m

質問8
0.25 mのNaOHを得るために1リットルの水(水= 1.00 g / mL)に溶解する必要があるNaOHの数(グラム)を決定します。
討論
知られている:
1Lの水= 1,000 mL = 1,000 g(水= 1.00 g / mLであるため)
m NaOH = 0.25 m
NaOh氏= 40
尋ねられた:gr…?
回答:
m NaOH = gr / Mr x 1000 / P
0.25 = gr / 40 x 1000 / 1,000
0.25 = g / 40
g = 0.25 x 40
g = 10グラム
したがって、必要なNaOHの量は10グラムです。
問題9
濃度が0.25M(Ar H = 1;)の4.9グラムのH2SO4を溶解するために必要な水の量を決定します。 S = 32; O = 16)!
討論
知られている:
m H2SO4 = 0.25
Mr H2SO4 = 98
gr = 4.9グラム
尋ねられた:p ???
回答:
m = gr / Mr x 1000 / P
0.25 = 4.9 / 98 x 1000 / p
p = 20グラム(20 mL)
したがって、水の量は20mLです。
質問10
0.6molのNaClを使用して1.2mの溶液を調製するには、どのくらいの量の水が必要ですか?
討論
モル濃度(m)= 1.2 mm =
nP
1,2 =
0,6P
P =
0,61,2
= 0.5 kg
したがって、必要な水の質量(溶媒の質量)は0.5kgです。
質問11
1 Lの溶媒に2モルの溶質が溶解しているとすると、モル濃度はどのくらいですか?
討論
溶質のモル数(n)= 2 molm =
nP
m =
21
= 2 m
750 mLの純水に溶解した25グラムのKBr(Mr = 119)のモル濃度を計算します。
討論
溶質= 25グラム
Mr = 119
溶媒(P)= 750 mL = 750グラム(水= 1.00 g / mLであるため)= 0.75 kgn =
溶質氏
n =
25119
= 0.21 mol
m =
nP
m =
0,210,75
= 0.28 m
それはからのレビューです Knowledge.co.idについて 約 モル濃度の問題の例 , うまくいけば、それはあなたの洞察と知識に追加することができます。 ご覧いただきありがとうございます。他の記事もお読みください。
