ボイルの法則:定義、式、アプリケーション、問題の例
ボイルの法則:定義、公式、アプリケーション、および問題の例 –このディスカッションでは、ボイルの法則について説明します。 これには、ボイルの法則の理解、ボイルの法則の公式、ボイルの法則の適用、およびボイルの法則からの質問の例が含まれ、完全かつ軽く議論されます。 詳細については、以下のレビューを注意深くお読みください。
目次
-
ボイルの法則:定義、公式、アプリケーション、および問題の例
- ボイルの法則の定義
- ボイルの法則
- ボイルの法則の適用
- ボイルの法則の例
- これを共有:
- 関連記事:
ボイルの法則:定義、公式、アプリケーション、および問題の例
まず、ボイルの法則について説明しましょう。
ボイルの法則の定義
ボイルの法則は、ガスの圧力と体積の関係を説明する物理法則の1つです。 ロバート・ボイルは、その年(1627-1691)にボイルの法則を発見した人物であり、一定温度での圧力とガスの体積の関係を知るために研究を行いました。 彼の研究から、ロバート・ボイルは、密閉された空間内のガスの圧力と体積の積が一定であることを発見しました。
ウィキペディアによると、ボイルの法則の別の定義は、多くの化学の法則の1つであり、理想的な化学の法則の特別な場合です。 閉鎖系で温度が一定のままである場合、ボイルの法則は絶対圧力と空気の体積の間の逆の関係を説明します。
ロバートボイルによって発見されたボイルの法則は、一定温度でのガスの体積に対する圧力の影響を研究しています。 このロバートボイルの声明はボイルの法則と呼ばれ、次のように書かれています。
「一定の温度では、密閉された空間内のガスの圧力はその体積に反比例します。」
日常生活では、自転車のポンプや注射器など、ボイルの法則に従って機能するツールの例によく遭遇します。

ボイルの法則
ボイルの法則によれば、これは、密閉された空間内のガスの圧力と体積の積が一定のガス温度で一定であることを意味します。
数式で記述された場合の上記のステートメント、すなわち:
P.V = C
ここで、Cは固定数(定数)です。 圧力を変えるとガスの量も変わるので、上記の式は次のように書くことができます。
P1。 V1 = P2。 V2
また読む:慣性モーメント:定義、要因、オブジェクトの形の方程式、および問題の例
条件の下で:
P1 =初期ガス圧(atm.cm Hg、N / m2、Pa)
P2 =最終ガス圧(atm、cm Hg、N / m2、Pa)
V1 =元のガス量(m3、cm3)
V2 =最終ガス量(m3、cm3)
ボイルの法則は、次の場合にのみ適用されます。
- 固定ガス温度または一定
- ガスは密室にあります
- 化学反応なし
- 気体状態に変化はありません
ボイルの法則の適用
ボイルの法則の適用は、ポンプの動作原理に基づいています。 ポンプは、気体/液体を輸送するために使用される装置です。 この動作原理によれば、ポンプは2つの部分、すなわち吸引ポンプと圧力ポンプに分けられます。
吸入後、ポンプ内の空気量が増加し、ゴム製のバルブ(ベント)から空気が入るため、タイヤに空気が入ることができません。
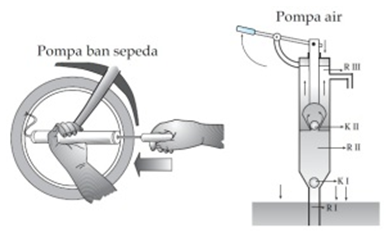
インレットを押すと、ポンプ内の空気量が減少し、圧力の上昇により、ベントチューブからタイヤに空気が入る可能性があります。 ボイルの法則を使用する同様のデバイスは、注射器、ピペット、圧力ポンプ、および水ポンプです。
ボイルの法則の例
以下は、ボイルの法則に関する問題の例です。
1. 密閉されたチャンバーには、200mlのガスが入っています。 部屋の圧力が60cmHgの場合、150 mlの体積で部屋のガス圧を計算しますか?
解決:
知られている:
V1 = 200 ml
P1 = 60 cmHg
V2 = 150 ml
質問: P2…?
回答:
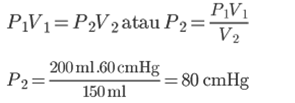
ボイルの法則によれば、250mlの容積の部屋のガス圧は80cmHGです。
2. 圧力を80,000Paに上げると、体積が0.2 m3の密閉空間で、ガスが充満しますか?
解決:
知られている:
P1 = 60,000 Pa
V1 = 0.2 m3
P2 = 80,000 Pa質問: V2…?
回答:
P1V1=P2 V2
V2 = (P1 V1): P2
V2 =(60,000 x 0.2):80,000
V2 = 1,2/8
V2 = 0.15 m3したがって、ガスの体積は0.15M3になります。
3. ボイルの法則については、p。 V = k、kには次元があります。
A。 力
B。 努力
C。 線形運動量
D。 温度
E。 バネ定数
回答:B
討論:
知られている: V.p = k
質問: k = …?
回答:
p。 V = k
k = p。 V =(m³)
k = Nm =ジュール
Jouleは作業単位です。 したがって、kには努力の次元があります。
4. 次のうち、ボイルの法則が発生する条件ではないものはどれですか。
また読む:クローン作成とは:定義、タイプ、利点、例
A。 固定温度
B。 固定容量と圧力
C。 化学反応は起こりません
D。 密閉空間内のガス
E。 ガスの状態は変わりません
回答:B
討論:
ボイルの法則は、一定のガス温度、密閉空間内のガス、化学反応なし、ガス状態の変化なしなどの特定の条件下でのみ適用されます。
5. 密閉容器内には、膨張してその体積が初期体積の2倍に変化するガスがあります(V =初期体積、P =初期圧力)。 ガス圧がに変わります...
討論
知られている :
初期圧力 (P1) = P
初期ボリューム (V1)= V
最終巻 (V2)= 2V
募集:最終的な圧力 (P2)
回答:
P1 V1 = P2 V2
P V = P2(2V)
P = P2(2)
P2 = P / 2 = P
ガス圧は初期圧力の倍に変化します。
6. 密閉容器の中には、圧力が2 atm、体積が1リットルのガスがあります。 ガスの圧力が4気圧に変わると、ガスの体積は...
討論
知られている :
初期圧力 (P1) = 2 atm = 2 x105パスカル
最終圧力 (P2) = 4 atm = 4 x105パスカル
初期ボリューム (V1) = 1リットル= 1 dm3 = 1 x 10-3 m3
募集:最終巻 (V2)
回答:
P1 V1 = P2 V2
(2 x 105)(1 x 10-3)=(4 x 105) V2
(1)(1 x 10-3)=(2) V2
1 x 10-3 =(2) V2
V2 = x 10-3
V2 = 0.5 x 10-3 m3 = 0.5 dm3 = 0.5リットル
7. 密閉チャンバーには、200mLのガスが入っています。 部屋の圧力が60cmHgの場合はどうなるので、体積が150mLの部屋のガスの圧力を計算しますか?
解決:
知られている:
V1 = 200 mL
V2 = 150 mL
P1 = 60 cmHg
質問: P2 =…?
回答:
P1。 V1 = P2。 V2
60cmHg。 20 mL = P2. 15 mL
P2 = 1200 cmHg / 15
P2 = 80 cmHg
したがって、それはについて説明されています ボイルの法則:定義、公式、アプリケーション、および問題の例、うまくいけば、あなたの洞察と知識に追加することができます。 ご覧いただきありがとうございます。他の記事もお読みください。
