化学平衡:定義、法則、式、問題の例
化学平衡:定義、法則、式、問題の例 –このディスカッションでは、化学平衡、式の法則について説明し、化学平衡の完全で軽い例を備えています。 詳細については、以下のレビューを注意深くお読みください。
目次
-
化学平衡:定義、法則、式、問題の例
- 化学平衡を理解する
-
平衡状態の特徴
- 化学平衡シフト
- 化学平衡に対する物質濃度の影響
- 化学平衡に及ぼす圧力と体積の影響
- 化学平衡に対する温度の影響
- 化学平衡の法則
-
化学平衡の一般式
- 不均一な平衡
- 均一な平衡
- 化学平衡ゾルの例
- 部分平衡定数
- 分圧平衡と平衡定数の関係
- これを共有:
- 関連記事:
化学平衡:定義、法則、式、問題の例
まず、化学平衡の意味について注意深く議論しましょう。
化学平衡を理解する
化学平衡は、反応物と生成物の速度が同じであり、それらの濃度が一定である可逆反応です。 化学平衡は、反応物が形成される速度が生成物が形成される速度と同じである可逆反応でのみ発生します。
化学平衡は動的であるため、しばしば動的平衡と呼ばれます。 動的平衡は、濃度条件が一定であるが実際には反応が継続的に起こっている場合の交互反応です。 動的平衡は巨視的には発生しませんが、微視的に発生します(物質の粒子)。
化学平衡は、反応物の形成速度が生成物の形成速度に等しい可逆反応でのみ発生します。 反応は微視的に連続的に起こるので、動的平衡と呼ぶことができます。
平衡状態の特徴
平衡状態の特徴は次のとおりです。
- 密閉容器内で、一定の温度と圧力で発生します
- 反応物への反応速度は、生成物への反応速度と同じです。
- 反応は2つの反対方向に連続的に(動的に)進行します
- 物質の粒子のレベルでの非常に微視的な発生
- 生成物と反応物の濃度は残ります
化学平衡シフト
物質の濃度、温度、圧力または体積など、化学平衡に影響を与えるいくつかの要因があります。
化学平衡に対する物質濃度の影響
1つの物質の濃度が増加すると、反応平衡は、濃度が追加された物質に向かって(離れて)シフトします。 1つの物質の濃度が低下すると、平衡はその物質の濃度が低下した方向にシフトします。
例:次の反応式で
N2(g)+ 3H2(g)<==> 2NH3(g)H = -92kJ。
N2の濃度を上げると、平衡反応は右にシフトします。これは、物質の濃度を上げると、平衡反応が追加された濃度の方向からシフトするためです。
N2の濃度を下げると、平衡反応は左にシフトします。これは、物質の濃度を下げると、平衡反応が濃度を下げた方向からシフトするためです。
また読む:分析化学、タイプ、および方法の理解(完全)
化学平衡に及ぼす圧力と体積の影響
システム内の圧力が増加するか、体積が減少すると、反応平衡はより少ない数の分子に向かってシフトします。
システム内の圧力が低下するか、体積が増加すると、平衡は分子の数が少なくなる方向にシフトします。
「圧力と体積は反比例の関係にあります」
例:次の反応式で
N2(g)+ 3H2(g)<==> 2NH3(g)H = -92 kJ
反応物のモル数= 1 + 3 = 4
生成物のモル数= 2
システム内の圧力が上昇すると、平衡反応は右にシフトします。 圧力を上げると、反応平衡は最小数の分子の方向にシフトします すなわち2。
システム内の体積が減少すると、平衡は右にシフトします。 システムの体積が減少すると、平衡反応はより小さな分子の方向にシフトします すなわち2。
システム内の圧力が低下すると、圧力が上昇すると平衡反応が左にシフトします。 したがって、平衡反応は、より多くの分子、つまり4に向かってシフトします。
システム内の圧力が増加すると、システムの体積が増加すると、反応平衡は左にシフトします。 したがって、反応平衡は、より多くの分子、つまり4の方向にシフトします。
化学平衡に対する温度の影響
システムの温度が上昇すると、平衡反応は、熱または支持を放出する物質の方向に移動します。
システムの温度が下がると、平衡反応は熱を放出する物質または発熱する物質の方向に移動します。
例:反応式で
[A] + [B] <==> [C] H = -X
[C]は発熱反応(熱を放出し、[A] + [B]は吸熱反応(熱を必要とする))です。
温度が上昇すると、平衡反応は左に移動します。 システムが増加すると、平衡反応は熱を必要とする反応の方向にシフトします。 吸熱。
温度が下がると、平衡反応は右に移動します。 システムが増加すると、平衡反応は熱を必要とする反応の方向にシフトします。 吸熱。
温度が下がると、平衡反応は右に移動します。 システムの温度が上昇すると、反応平衡は熱を放出する方向にシフトします 発熱。
化学平衡の法則
化学平衡または平衡定数の法則は、各反応物濃度の係数の累乗に対する生成物濃度の、それぞれの係数の累乗に対する比率です。 平衡定数は、KまたはKcで表すことができます。
また読む:添加物* f:定義、性質、種類、影響
化学平衡の一般式
化学平衡方程式または式は次のとおりです。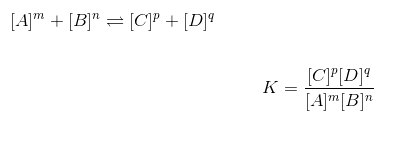
不均一な平衡
この不均一な平衡状態での反応に関与する物質の形態が異なるため、 平衡定数を決定することは、平衡定数が影響を受ける物質の濃度です。 とガス。
均一な平衡
この均一な平衡では、反応に関与する物質の形状は同じであるため、平衡定数を決定するために使用される物質のすべての濃度。 ただし、平衡定数への影響は気体と溶液の形でのみ発生することを覚えておく必要があります。
化学平衡ゾルの例
与えられた平衡反応
2A + B <==> A2B
最初は2リットルの容器に2モルのAと2モルのBがありますが、平衡状態にある0.5モルのAの場合、平衡定数はどのくらいですか?
回答:
上記のステートメントに基づいて、モル数は次のように決定できます。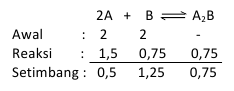
次に: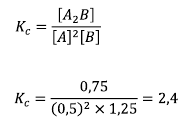
問題のボリュームは、お互いを排除するため、効果があります。
部分平衡定数
部分平衡定数は、生成物の分圧とそれぞれの係数の累乗の積と、反応物の分圧とそれぞれの係数の累乗の比です。 部分平衡定数はKpで表すことができます。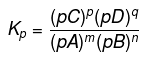
情報
P =分圧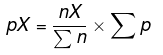
情報:
pX =見つけるための分圧
nX =分圧を求める物質のモル数
En =システムの総モル数
Ep =システムの全分圧
問題の例:
合計6モルのNH3が加熱され、N2とH2が形成されます。 平衡に達したとき、2モルのNH3が残ります。ガス混合物の全圧が10気圧の場合、Kp!の値を決定します。
回答:
上記の質問から、次のデータを取得できます。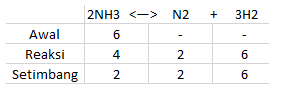
システム内の総モル数: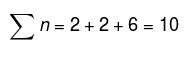
次の方程式を使用して、各物質の分圧を求めます。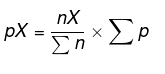
したがって、pBH3 = 2 atm、pN2 = 2 atm、およびpH2 = 6atmが得られます。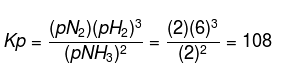

分圧平衡と平衡定数の関係
この関係は、次の式で表すことができます。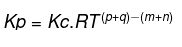
情報:
R =ガス定数
T =温度
p、q、m、n =反応物質の係数
解離度
解離の程度は、物質のいくつの部分が解離するかを決定するために使用される値です。 解離度の式は次のとおりです。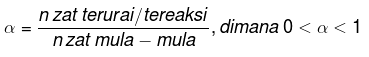
平衡定数の意味
平衡定数は、次のようないくつかの機能に使用できます。
- 平衡位置についての手がかりを与えます
- 反応の方向を推定する
したがって、それはについて説明されています 化学平衡:定義、法則、式、問題の例、うまくいけば、あなたの洞察と知識に追加することができます。 ご覧いただきありがとうございます。他の記事もお読みください。
