電解槽、タイプ、反応、部品、例を理解する
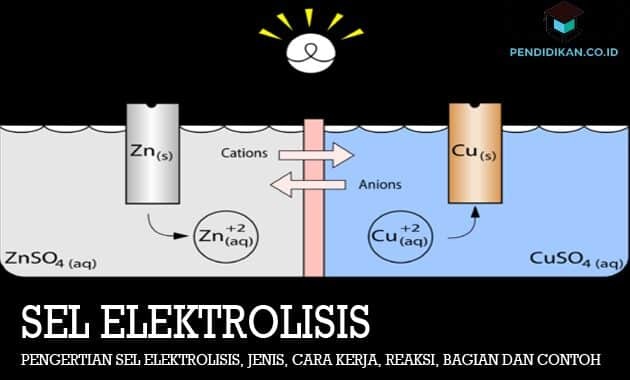
電解槽とは
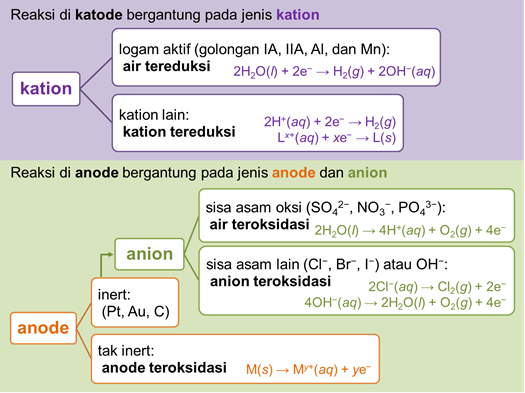
この電解セルは、レドックス反応を実行するために使用される電気エネルギーが自発的ではない電気化学セルです。 電気分解反応は、電流を使用した物質の分解反応として定義できます。 電解セルの動作原理は、電流源の負極を陰極の方向に接続し、正極も接続することです。 自発的ではない、または起こり得る還元および酸化反応を引き起こす過電圧が存在するように、アノードに接続します。 電子は陰極から陽極に流れます。 正イオンは陰極に引き付けられて還元される傾向があり、負イオンは陽極に引き付けられて酸化される傾向があります。
電解槽の配置
一般に、この電解セルは次のもので構成されています。
- バッテリーなどの直流(DC)を供給する電源。
- アノードは、酸化反応が発生する電極です。
- カソードは、還元反応が起こる電極です。
- 電解質は電気を通すことができる物質です。
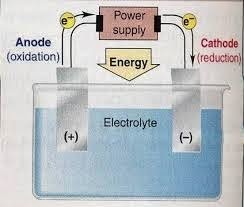
上の写真では、溶融NaCl電解セルの回路を見ることができます。 電解セルは、ボルタ電池の場合のように塩橋を必要としません。 使用される電極は、セル内で酸化も還元もされない白金やグラファイトなどの不活性電極である場合とそうでない場合があります。
この電気分解プロセスは、電圧源から同じ方向に流れる電流から始まります。 負極からの電子は陰極に向かって流れます。 その結果、溶融NaCl中の正のNa +イオンが陰極に引き付けられ、電子を吸収して中性のNaに還元されます。 一方、溶融物中の負のCl-イオンは、正極のアノードに引き付けられます。 Cl-イオンは、電子を放出することによって中性のCl2ガスに酸化されます。 次に、電子はアノードに流れ、電圧源の正極に転送されます。 したがって、溶融NaCl電解セルで発生する酸化還元反応は次のように書くことができます。
- カソード(還元)= Na +(l)+ e−→Na(l)
- アノード(酸化)= 2Cl−(l)→Cl2(g)+ 2e−
- セル反応(レドックス)= 2Na +(l)+ 2Cl-(l)→2Na(l)+ Cl2(g)
電解槽部
電解セルには、この電気化学的イベントまたは発生の発生のためにもちろん満たされなければならない回路のいくつかの部分があります。 電解セルの主要部分は次のとおりです。
電極

この電極は、電流を流すことができる、または行うことができる導体であり、電解セルでは、電極はアノードとカソードの2つのタイプに分けられます。
電気分解プロセスでは、各アノードには独自の機能があります。これは、 酸化反応の場として機能するとともに、反応が起こる場所としての機能を持つ陰極として機能します 削減。 これらの反応は両方とも互いに補完し合い、常に同時に発生します。
これらの電極の選択は、反応する物質に合わせて調整された還元電位の値から見ることができます。 基本的に、選択された電極は不活性であるか、溶液に反応しないか、または 使用される試薬とこれらの電極は、反応できる、または反応できる活性特性を持っています 解決。
しばしば使用される不活性電極の例には白金と炭素が含まれ、一方、しばしば使用される活性電極には銅とニッケルが含まれます。
電解質
この電解質は、電気を通すことができるか、または高い電気伝導率を持っている解決策です。 基本的に、電解質溶液はかなり高濃度でイオンを溶解しています したがって、これから、溶液中のイオンの動きは、 その導電率。
電解液中のイオンが反応し、良好な反応を経験します 電極内部で発生する還元または酸化、つまり電流の存在下で 逃した。 電解質溶液の例は、CuSO4とNaClです。
電流源
この電流源は、還元反応や酸化反応の発生にも非常に重要です。 電流は、反対の電荷を持つ2つの電極を通って電解質溶液に流れる直流(DC)の形をとることができます。
この電流の存在は確かにアノードからカソードへの電子の移動を引き起こし、それによりアノードでの反応が酸化状態で起こり、カソードで還元が起こる。 電流がないと、システム内に電子移動がないため、この還元および酸化反応は起こりません。
電解槽の種類
これらの電解槽は、電解液の種類や使用する電極によって分類できます。 以下は電解槽の種類です。
溶融/溶融電解セル
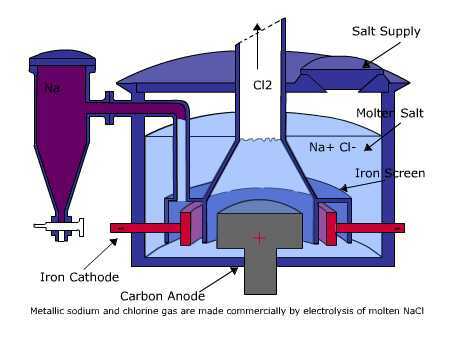
この電解セルは、水溶媒の非存在下で物質の溶融または融合の形で電解質を備えた電解システムです。
このタイプの電解質には、H2O分子のない陽イオンと陰イオンしかありません。 このタイプの電気分解でも、陽イオンは陰極で還元されますが、陰イオンの場合は陽極で直接酸化されます。 このタイプの電気分解の例は、溶融NaClを使用することです。
溶液電解セル
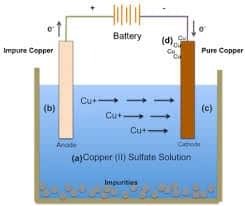
このタイプは、使用される電解質が溶媒として水を含む溶液の形である以前のタイプの反対です。 これは、電解質に陰イオン、陽イオン、およびH2O分子が存在することを意味します。 したがって、水の存在のために、反応中に競争が発生することも考慮されます 行われます。
この溶液の電気分解も2つのタイプに分けられます。すなわち、不活性電極と活性電極による溶液電気分解です。 この電解セルの例は、CuSO4の電解液を使用することです。
電解槽のしくみ
3つの完全な主要コンポーネントで組み立てられた、または組み立てられた電解セルでは、セルを適切に実行できます。 この電解セルの動作原理は、セル内に電流が流れるときです。 電極、アノードでは正電荷が与えられ、カソードでは充電されます 負。
次に、電流の結果として電子の動きがあり、電子はアノードからカソードに移動します。 その結果、アノード内の電子が不足するため、アノードは溶液から電子を引き付けます。 負の電荷を持ち、損失によって酸化反応も起こす陰イオンを含む電解質 電子。
この陰極には多くの負電荷があるため、陰極を中和するには正電荷が必要です。 したがって、この陰極は電解質中の陽イオンを引き付ける傾向があるため、陽イオンは次のものを受け入れることによって還元されます。 電子。
電気分解反応
一般に、溶融イオン性化合物の電気分解には、より単純な酸化還元反応が含まれます。 これは、水の不在下では、陽イオンが陰極で還元され、陰イオンが陽極で酸化されるためです。 たとえば、溶融したMgBr2の電気分解では、Mg2 +イオンがカソードで還元されてMg金属を形成し、Br-イオンがアノードで酸化されてBr2ガスを形成します。
ただし、電解反応が溶液系で行われる場合、いくつかの競合するレドックス反応が存在するため、これから反応はかなり複雑になる傾向があります。 この電解液の電解反応を決定する要因には、次のようなものがあります。
1. 電解液のセッション
この還元種は、より正の還元電位を持つ種です
この酸化種は、より負の還元電位(より正の酸化電位)を持つ種です。
2. 電極材料の性質、不活性または活性
この不活性電極は、電気分解の酸化還元反応に関与しない電極です。 例としては、プラチナ(Pt)、金(Au)、グラファイト(C)などがあります。
この活性電極は、電解酸化還元反応に関与する可能性がある、または関与する可能性がある電極です。 例としては、銅(Cu)、クロム(Cr)、ニッケル(Ni)などがあります。
3. 与えられた追加のポテンシャル(過電圧)
過電圧は、電気分解によってガスが生成されるときに一般的に発生する電極表面の相互作用を超えることができるようにするために必要です。
標準電極電位データに基づいて、標準条件下での電解質溶液の電解反応は、以下の規定に従うことによって予測することができます。
たとえば、AgNO3溶液のグラファイト電極とそれに続く銀(Ag)電極による電気分解の違いを観察できます。
a。 グラファイト電極によるAgNO3溶液の電気分解
カソードでは、この還元を受ける化学種はAg +です。 これは、Agは、水の還元電位よりも還元電位が負の活性金属ではないためです。
カソード:Ag +(aq)+ e−→Ag(s)
アノードでは、グラファイト電極は不活性電極であるため、酸化されません。 このNO3-種は酸化しにくい酸素酸の残留物であり、その結果、水が酸化されます。
アノード:2H2O(l)→4H +(aq)+ O2(g)+ 4e−
b。 銀電極によるAgNO3溶液の電気分解
カソードで還元を受ける化学種はAg +です。 カソードで還元される化学種は、使用する電極に依存せず、電解液中のカチオンのタイプにのみ依存します。
カソード:Ag +(aq)+ e−→Ag(s)
アノードでは、Ag電極は不活性電極ではないため、酸化されます。
アノード:Ag(s)→Ag +(aq)+ e−
電解槽の問題と考察の例
以下に電気分解反応を書いてください。
a。 銅電極によるCuSO4溶液の電気分解
b。 グラファイト電極によるKI溶液の電気分解
c。 白金電極による溶融CaCl2の電気分解
回答:
- CuSO4(aq)→Cu2 +(aq)+ SO42−(aq)
このCuは活性金属ではないため、これによりCu2 +カチオンがカソードで還元されます。 したがって、銅(Cu)電極は不活性電極ではないため、Cuアノードは酸化されます。
カソード:Cu2 +(aq)+ 2e−→Cu(s)
アノード:Cu(s)→Cu2 +(aq)+ 2e−
セル反応:Cu(s)アノード→Cu(s)カソード
- KI(aq)→K +(aq)+ I−(aq)
このKは活性金属であるため、その水からカソードで還元されます。 したがって、このグラファイト電極には不活性電極が含まれ、I-アニオンには残りのオキシ酸が含まれないため、I-アニオンはアノードで酸化されます。
カソード:2H2O(l)+ 2e-→H2(g)+ 2OH-(aq)
アノード:2I−(aq)→I2(g)+ 2e−
細胞反応:2H2O(l)+ 2I-(aq)→H2(g)+ 2OH-(aq)+ I2(g)
- CaCl2(l)→Ca2 +(l)+ 2Cl-(l)
白金電極を使用した溶融CaCl2イオン性化合物の電気分解用(これには以下が含まれます) 不活性電極)、Ca2 +カチオンはカソードで還元され、Cl-アニオンは酸化されます アノードで。
カソード:Ca2 +(l)+ 2e−→Ca(s)
アノード:2Cl−(l)→Cl2(g)+ 2e−
細胞反応:Ca2 +(l)+ 2Cl-(l)→Ca(s)+ Cl2(g)
これは、電解セルの定義、タイプ、仕組み、反応、部品、および例の説明です。説明されている内容が役立つことを願っています。 ありがとうございました
関連項目同化作用の定義
関連項目スタートアップを理解する
関連項目専門家によると、一般的な政治文化の理解、特徴、種類
