熱力学、原理、概念、公式、法則、例の定義

熱力学の定義
熱力学のこの定義は、熱を変化させる努力を説明/説明する科学です(つまり、 温度差によって引き起こされるエネルギーのエネルギーへの移動)および 彼の支持者。 熱力学は、エネルギー、仕事、熱、エントロピーの物理学、およびプロセスの自発性と密接に関連しています。
それとは別に、熱力学は静的力学にも関連しています。 次に、この物理学の分野では、熱と仕事の形でエネルギーの交換を研究し、システムと環境を制限します。 この熱力学の適用と適用は、ホットコーヒーを吹くイベントや発生など、人体で発生する可能性があります。 冷蔵庫、電子機器、自動車、発電所、そして産業、これらは生命が遭遇する最も一般的な熱力学的イベントです 毎日。
熱力学の法則
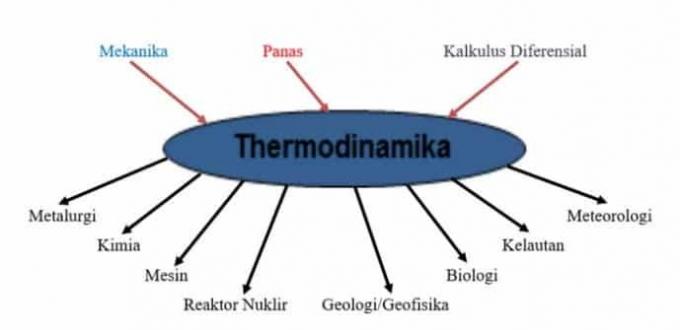
力学、熱、微分計算を含む熱力学の法則を他の科学に適用するために、この図に示します。
次の図は、熱力学の問題/問題の解決が、次のようないくつかの段階を経ることによって実行されることを示しています。
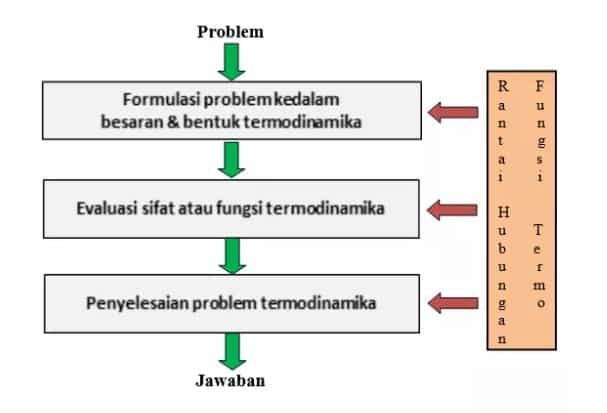
問題の熱力学的量と形式への定式化。 これは、問題の言語を熱力学の言語に変更し、熱力学量を使用してそれを定式化することによって言います。
熱力学的特性と機能の評価。これは、最初のステップ(1)で調製されたまたは調製された製剤の分析を行うことを意味します。 この段階では、問題の方向や目的を誤解しないように、熱力学的知識を十分に理解する必要があります。
熱力学的問題の解決。 この段階では、有効または説明責任のある回答を得ることができるように、数学/微積分の知識(微分、積分)のサポートが必要です。
熱力学を解くこれらの3つのステップは、熱力学の仮定または規則に基づいている必要があります。
本質的に、この熱力学の法則は、実際には日常生活で起こる自然なことです。 科学技術の発展に伴い、熱力学はそのように設計されています それが人間を助けることができる、または助けることができるメカニズムの形になるような方法で その活動。 17世紀以降の熱力学の科学の発展により、このような熱力学の幅広い応用が可能になりました。 次に、熱力学の科学の発展は、巨視的なアプローチ、つまり、エネルギー担体となる物質粒子の一般的な振る舞いから始まります。
熱力学的プロセス
熱力学的プロセスは、プロセスが発生したときの圧力、体積、および温度の状態に応じて、4つのタイプに分けられます。 このプロセスは通常、プロセスが発生したときの圧力(P)と体積(V)を表す図であるP-V図に示されます。 すべてのタイプの熱力学的プロセスから覚えておくべき2つの重要なことがあります。つまり、変化する変数と実行される作業です。 熱力学的プロセスで発生する仕事は、P-Vグラフの面積を計算することで知ることができます。
等圧プロセス
この等圧は、システム圧力の値を変更しない熱力学的プロセスです。 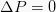
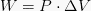
この式から、体積が増加すると(膨張が発生すると)、 その後、ビジネスはポジティブであり、ボリュームが減少した場合(減価償却が発生した場合)、ビジネスは価値があります 負。

定積過程
この定積は、システムの体積値を変更しない熱力学的プロセスです。 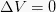

等温プロセス
この等温線は、システムの温度値を変更しない熱力学的プロセスです。 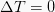
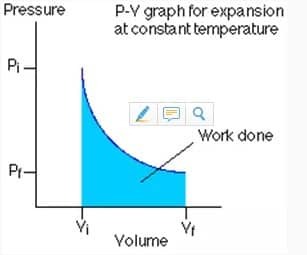
等温処理された仕事の価値は、次の式で表されます。
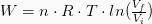
ここで、nはモルで表される物質量、Rは気体定数、Tは温度です。 この式は、P-V図の仕事方程式と理想気体方程式を組み合わせることによって得られます。
アディバティックプロセス
断熱は、システムの発熱量を変化させない熱力学的プロセスです(Q = 0)。

単原子ガスでは、断熱過程で行われる仕事は次の方程式で表すことができます。
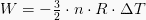
一見すると、これらの断熱プロセスと等温プロセスは同様のP-V図を持っています。 詳細には、次の図の例に示すように、断熱プロセスの勾配が等温プロセスよりも急であることがわかります。

プロセス全体をP-Vダイアグラムとして記述すると、次のグラフが得られます。 計算に使用される単位は国際単位であることを覚えておく必要があります。 たとえば、使用される温度の単位はケルビン、体積の単位はm3、物質量の単位はモルです。
熱力学系
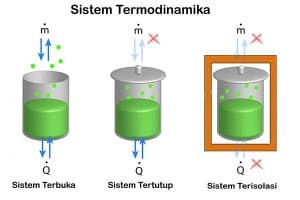
この熱力学的システムは、重要な宇宙の一部です。 実在または架空の境界は、環境と呼ばれる宇宙からシステムを分離します。 システムと環境の境界の性質、およびシステムと周囲の間の物質、熱、エントロピーの伝達に基づく熱力学システムの分類。
システムと環境の間で発生する交換のタイプに基づいて、システムには3つのタイプがあります。
閉鎖系
エネルギー(熱と仕事)の交換はありますが、環境との物体の交換はありません。 温室は、熱交換が発生するが環境との仕事の交換がない閉鎖系の例です。 システムが熱を交換するか、仕事を交換するか、またはその両方を交換するかは、通常、その制限特性と見なされます。
- 断熱バリア:熱交換を許可しません
- 堅い障壁:仕事の交換を許可しません。
隔離されたシステム
熱、物質、または環境との仕事の交換はありません。 この断熱システムの例は、断熱ガスボンベなどの断熱コンテナです。
オープンシステム
エネルギー(熱と仕事)と物体の環境との交換があります。 オブジェクトの交換を可能にするバリアは、透過性と呼ばれます。 この海はオープンシステムの一例です。
実際には、システムは環境から完全に分離できないか、完全に分離できます。 ほんの少しの撤退であっても、多少の混合が必要だからです 重力。 分離システム分析では、システムに入るエネルギーはシステムから出るエネルギーと同じです。
熱力学的状態
システムが特定の状態で平衡状態にある場合、それは確定状態(またはシステムの状態)と呼ばれます。
特定の熱力学的状態または状況に対して、システムの多くのプロパティが指定されます。 システムが状態を形成するパスに依存しないプロパティは、システムの状態関数と呼ばれます。 このセクションの次のセクションでは、状態関数であるプロパティのみを検討します。
特定のシステムの状況または状態を説明するために指定する必要のある最小プロパティの数は、ギブズの相法則によって決定されます。 通常、その人は、この最小量よりも大きいシステムプロパティに直面します。
異なる状況のプロパティ間の関係の開発が可能です。 この状態方程式は、そのような関係の例です。
熱力学の基本法則

熱力学システムに適用される4つの基本法則には、次のものがあります。
熱力学のゼロ法則
最初の法則は、2つのシステムが平衡状態にある、つまり3番目のシステムと平衡状態にあると述べており、3つすべてが互いに平衡状態にあります。 法律は最初の法律の後に入力されます。
熱力学の第一法則
同じ法則がエネルギー保存の法則にも当てはまります。 法則は、閉じた熱力学系の内部エネルギーの変化を述べています、それは同じです システムに供給される熱エネルギーの量と、 システム。 法則は、等温、等圧、等圧、および断熱を伴うプロセスを含む、いくつかのプロセスに分解することができます。
熱力学の第二法則
熱力学の第二法則はエントロピーを扱います。 熱力学の第二法則には音がありません。ケルビン・プランクとクラウジウスによって発行された実験的事実について、またはそれについての声明は1つだけです。
- クラウジウスの声明は、システムがそのような方法で機能することは不可能であり、その場合、唯一の結果は次のようになるというものです。 は、特定の温度のシステムからより高い温度のシステムへの熱としてのエネルギーの伝達です。 高い。
- Kelvin-Planckの声明は、システムがサイクルで動作することは不可能であるというものです。 熱力学と1の熱エネルギーを受け取りながらそれの周りのいくつかのネットワークも提供 熱源。 (工学熱力学の基礎(Moran J.、Shapiro N.M. – 6thed。 – 2007–Wiley)第5章)。
孤立した熱力学系の総エントロピーは時間とともに増加する傾向があり、その後 エントロピー増加の原理とも呼ばれる最大値「これは上記のIIステートメントの相関関係です(2番目の分析 プロセスの熱力学は、エントロピーのプロパティを使用または使用することです)(ソースエンジニアリング熱力学の基礎(Moran J.、Shapiro N.M. –第6版 – 2007 – Wiley))第6章)。
熱力学の第三法則
熱力学の第3法則は、絶対零度を扱います。 この法則は、システムがゼロの温度に達すると、 絶対値の場合、プロセス全体が停止し、システムのエントロピーは次の値に近づきます。 最小。 法則はまた、絶対零度で完全結晶構造を持つ物体のエントロピーはゼロであると述べています。
熱力学の問題の例
初期体積が10m3のガスは、最終体積が25m3になるまで等圧条件下で加熱されます。 ガスの圧力が2atmの場合、ガスの外部作用を決定します。 (1気圧= 1.01 x 105 Pa)。
回答:
ことを指摘:
V2 = 25 m3
V1 = 10 m3
P = 2 atm = 2.02×105Pa
質問はWですか?
同重体→固定圧力、式W = P(ΔV)を使用します
W = P(V2 V1)
W = 2.02x 05 x(25 10)= 3.03×106ジュール
したがって、熱力学、原理、概念、公式、法則、および例の定義の説明、うまくいけば、説明されていることがあなたに役立つことができます。 ありがとうございました
関連項目命令型、宣言型、質問型の文、特徴、例を理解する
関連項目規範、機能、特性、種類、例の定義
関連項目ヘモグロビン(Hb)、機能、原因および構造の定義
