ベンゼンの定義、特性、構造、誘導体および分類
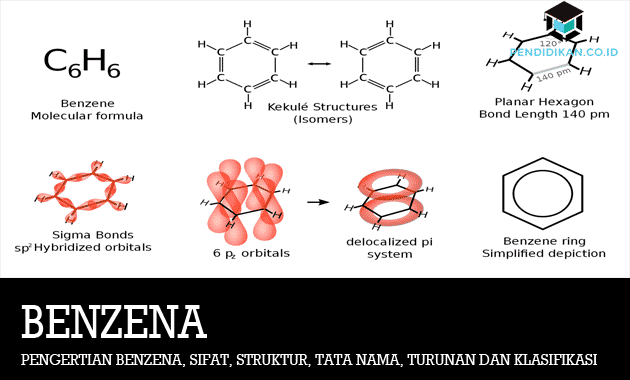
ベンゼンの定義
ベンゼンはもともとコールタールから作られた石油製品であり、あらゆる種類の消費者製品や工業製品の成分として使用されています。 ベンゼンはファラダットの男性によって発見され、その後分子式は後にミッシェリッヒによってC6H6として決定されました。 ベンゼンも炭化水素化合物のクラスに含まれます。 ベンゼンは飽和度が高いです。
ベンゼン化合物とその誘導体の多くは、芳香族化合物に分類されます。 これらの化合物のいくつかが持つ香りに基づいて分類されています。 ただし、化学者はこれらの化合物を次のように分類しなくなりました。 その物理的特性のみに基づいていますが、構造と その反応性。
ベンゼンの性質
一般に、これらの化合物の特性は、物理的特性と化学的特性の2つに分類できます。
1. 物理的特性
ベンゼンは無色で揮発性で毒性の高い液体です。 このベンゼンは、溶媒、あらゆる種類の炭素化合物のシンセサイザー、および炭素化合物を製造するための基本的な材料として使用できます。 ベンゼンは非常に反応性が高いわけではありませんが、炭素含有量が非常に高いため、非常に可燃性です。
ベンゼンのいくつかの誘導体には、極性と非極性の特性があります。 この極性化合物は、各元素の電子間に結合が存在することによって形成される化合物です。 ベンゼンとその誘導体の沸点は、摂氏80〜250度から始まります。 融点も変化し、安息香酸(-COOH)の化合物の最高値は摂氏122度です。
沸点の変動は、官能基の極性の影響によって引き起こされます。 同様に、融点は代替物の存在によって影響を受けます。 ベンゼンと同様に、トルエン、エチルベンゼンには非極性の特性があります。 アニリン、ベンジルアルコール、フェノール、安息香酸には極性があります。 したがって、安息香酸は極性が高いため沸点が最も高く、ベンゼンの場合は沸点が最も低いと結論付けることができます。
非極性特性を持つベンゼン誘導体化合物は水に溶解しませんが、逆に極性特性を持つベンゼン誘導体化合物は水に溶解します。
物性の特徴
- 揮発性液体
- 無色
- 特別なにおい
- 融点5.53ºC
- 沸点80.1ºC
- 非極性化合物
2. 化学的特性
この程度の酸性度は、ベンゼンとその誘導体の化学的性質の1つです。 フェノールと安息香酸は弱酸です。 安息香酸はフェノールよりも強いです。 -OH官能基を持つフェノールは、実際には弱酸です。つまり、H +イオンを生成します。 一方、-NH2基を持つアニリンは弱塩基であり、イオンを受け入れることを意味します H +。 ベンゼンは、付加反応よりも置換反応を起こしやすいです。
化学的特性
- ベンゼン中の水素原子の置換がベンゼン誘導体化合物として知られている付加または置換反応を経験する。
- 共鳴を経験する共役結合はベンゼンの結合を非常に安定させることができるか、または引き起こす可能性があるため、反応性が低くなります。 したがって、ベンゼンへの反応は一般に反応を加速するための触媒を必要とします。
- カジノジェニック(有毒)特性を持っています。
- 非極性化合物。
- 反応性は低いですが、可燃性であり、煤を大量に生成します。
- 添加よりも置換反応の方が簡単です。
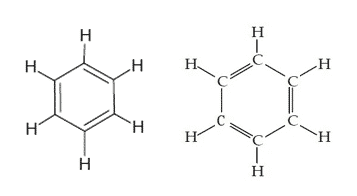
ベンゼン構造式
ベンゼンの構造は、単結合と二重結合が交互に含まれる6員(六角形)の環として記述されています。
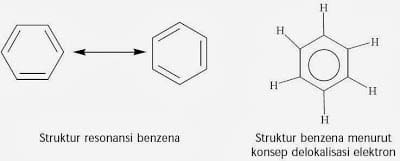
ケーキの構造。これは、水素上の臭素原子を置換すると、6つの炭素原子と水素がすべて同等であるため、同じ化合物が生成されることを示しています。 ケクレは、ベンゼンが反応すると、 臭素を使用し、FeCl3触媒を使用すると、分子式が1つの化合物のみになります。 C6H5Br。
ベンゼン環は、円の付いた正六角形の形で表示されます そこに含まれ、六角形の各コーナーで次にバインドするという規定があります H原子。
ベンゼンの命名法
以下はベンゼンの命名法であり、説明は次のとおりです。
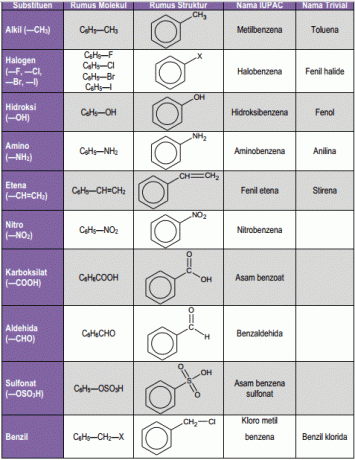
1. ベンゼン一置換

アルキル置換基が1つあるベンゼンは、エチルベンゼンなどのベンゼン誘導体と呼ばれます。 IUPACシステムでは、トルエン、クメン、スチレンなど、一部の一置換ベンゼンの一般名が引き続き使用されています。
フェノール、アニリン、ベンズアルデヒド、安息香酸、アニソールなどのこれらの一般名は、IUPACシステムでも引き続き使用されています。 IUPACシステム(国際純正応用化学連合)は、化合物の命名法を策定する権限を与えられた機関です。
2. ベンゼン代替
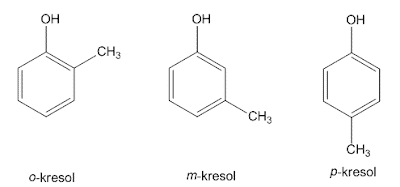
この置換は、ベンゼンが2つの置換基に結合するため、3つの構造異性体を持つことができます。 2つの置換基が1,2-炭素原子によって結合されている場合、それは互いにオルト(o)1と呼ばれ、1,3-炭素がメタ(m)と呼ばれ、1,4がパラ(p)と呼ばれます。
このIUPACシステムでは、ジメチルベンゼンの3つの異性体、つまりo-キシレン、m-キシレン、p-キシレンに一般名キシレンを使用しています。 2つのomo置換基に特別な名前が付けられていない場合、各置換基には 番号、名前はアルファベット順に並べ替えられ、単語で終わります ベンゼン。 この置換基がアルファベット順に結合している炭素原子には1の番号が付けられています。
3. ベンゼンの多置換

ベンゼン環に3つ以上の置換基が結合している場合、これらの置換基のそれぞれの位置は番号で示されます。 置換基の1つに特別な名前が付けられている場合は、化合物の名前が、つまりその特別な名前の派生語として与えられます。 そして、すべての置換基に特別な名前が付けられていない場合、それらの位置は次のようになります。 数字で表され、アルファベット順に並べ替えられた後、単語で終わります ベンゼン。
ベンゼン反応
一般的な反応は求電子置換反応であり、次の4つのタイプがあります。
1. ハロゲンによる置換(ハロゲン化)
このベンゼンは、ハロゲン化鉄(III)触媒を使用してハロゲンで置換されます。 例は次のとおりです。
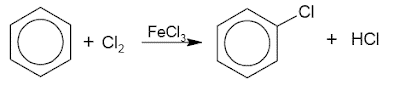
2. 硝酸による置換(ニトロ化)
このベンゼンは、濃硫酸触媒を使用して濃硝酸と反応し、ニトロベンゼンを形成します。 次のような例:
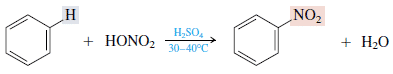
3. 濃硫酸による置換(スルホン化)
このスルホン化は、ベンゼンを濃硫酸で加熱すると発生します。 次のような例:
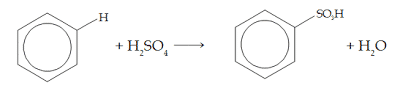
4. ハロゲン化アルキルによる置換(アルキル化)
この反応は、塩化アルミニウム(AlCl3)触媒を使用してアルキルベンゼンを形成するために使用できます。 次のような例:
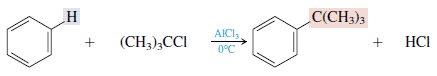
ベンゼンの分類と使用
以下は、ベンゼン誘導体と日常生活でのそれらの使用法です。
-
ベンゼン
ベンゼンは、スチレンモノマー(C6H6 – CH = CH2)の製造の基本材料である溶媒として広く使用されています。 このスチレンモノマーは、合成ゴム、農薬成分、人工甘味料を製造する際のポリマー材料です。 それとは別に、ベンゼンはナイロンベースの材料としても使用されます。 -
安息香酸(C6H5COOH)
安息香酸またはそのナトリウム塩は、あらゆる種類の食品または飲料の調製物の防腐剤として使用されます。 この酸または塩は、保存食品の味に影響を与えないために選択されました。 -
フェノール(C6H5OH)
フェノールは微生物を殺すことができるか、殺すことができるので、床クリーナー(炭酸)などの殺菌剤として使用されます。 -
サリチル酸
この酸はo-ヒドロキシ安息香酸として知られています。 このため、皮膚粉末などの皮膚の防腐剤として広く使用されています。 また、アスピリンのような頭痛の緩和剤としてです。
ベンゼン誘導体化合物
-
スチレン
ビニルベンゼンまたはフェニルエチレンとしても知られるスチレンは、ベンゼンの液体誘導体です。 色がなく蒸発しやすい油のように、濃度が少し腐っていてもいい匂いがします。 高い。 -
フェノール
フェノールは酸性の性質を持つ化合物であり、一般に防腐剤として使用され、しばしば炭酸とも呼ばれます -
アルキルベンゼン
アルキルベンゼンは、酸化されると安息香酸を生成する可能性があります。 この反応は炭素原子の数とは無関係です -
ニトロベンゼン
ニトロベンゼンは爆発性化合物であるため、このニトロベンゼン化合物は爆発物としてよく使用されます -
トルエン
トルエンは無色の液体で、水に溶けず、シンナーのようなにおいがします。 -
アニリン
アニリンはアミン基に結合するベンゼン化合物です -
安息香酸
安息香酸は最も単純な芳香族カルボン酸です。 安息香酸は白色の固体です。 安息香酸は他の化学物質の合成によく使用されます
ベンゼンとその子孫の使用
ベンゼンは通常、エチルベンゼン、シクロヘキサン、クメンなどの他の化合物の製造原料として使用されます。 このベンゼン誘導体は、他の化合物の製造にも一般的に使用されています。
したがって、ベンゼンの定義、特性、構造、命名法、誘導体、および分類の説明、うまくいけば、説明されていることがあなたに役立つことができます。 ありがとうございました
関連項目葉緑体、機能、構造およびそれらがどのように機能するかを理解する
関連項目税金:専門家による定義、機能、利点、および種類
関連項目BUMS、特性、機能、タイプ、目的、および例を理解する
