イオン結合の定義、用語、特性、特性、形成、例
イオン結合の定義
このイオン結合は、正イオンと負イオンの間の引力の結果として形成される結合です。 これらの正イオンは、金属元素が電子を失うために形成され、負イオンは、非金属元素が電子を獲得するために形成されます。 このイオン結合は、電子の移動によって発生します。
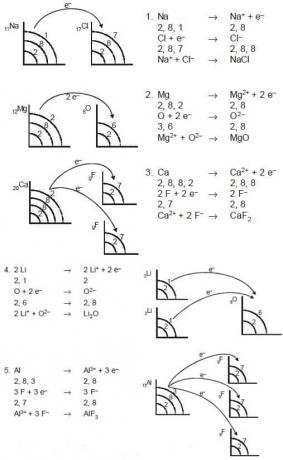
このイオン結合は、原子を結合することによって電子を失うか、または受け入れるプロセスの結果として形成されます。 電子を失う原子は正イオン(陽イオン)になり、電子を受け取る原子は負イオン(陰イオン)になります。 これらのイオン結合は通常、電気価結合と呼ばれます。 イオン結合を持つ化合物は、イオン性化合物と呼ばれます。 これらのイオン性化合物は通常、金属元素と非金属元素の原子間で形成されます。 金属元素の原子は電子を失って正イオンを形成する傾向があり、非金属の原子は電子を獲得して負イオンを形成する傾向があります。 例としては、MgO、CaF2、NaCl、Li2O、AlF3などがあります。
原子結合の形成条件
次に、これらの原子のそれぞれが希ガスの電子構造のようなバランス/安定性を達成したいので、原子はイオン結合を形成します。 イオン結合は、次の間に形成されます。
- マイナスイオンとプラスイオン、
- これらの原子は、大きな電子親和力の原子(グループIAの原子、グループVIAの原子を持つIIA元素、VIIA元素)を持つ小さなイオン化ポテンシャルエネルギーを持っています。
- 電気陰性度が小さい原子は、電気陰性度が大きい原子です。
イオン結合は、ある原子から別の原子への電子の移動によって発生する結合です(JamesE。 ブレイディ、1990)。 イオン結合は、電子を放出する原子(金属)と電子を獲得する原子(非金属)の間にあります。 金属原子は、電子を放出した後、陽イオンに変わります。
この原子は金属ではありませんが、電子を受け取った後、マイナスイオンに変わります。 電荷が反対のイオンの間には、イオン結合(静電結合)と呼ばれる引力(静電力)があります。 イオン結合を持つ化合物は、イオン性化合物と呼ばれます。 これらのイオン性化合物は通常、金属元素と非金属元素の原子間で形成されます。
イオン結合の形成
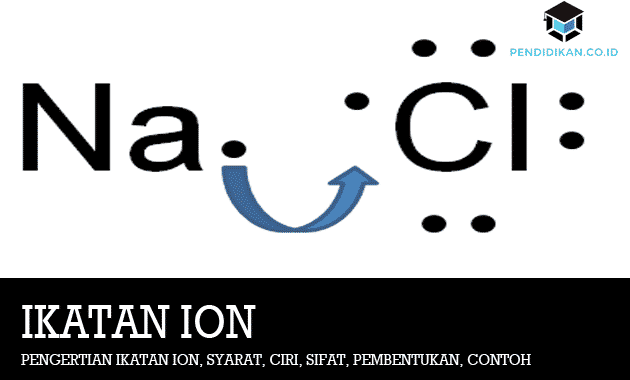
イオン結合を形成するプロセスは、NaClの形成によって例示されます。 ナトリウム(Na)は電子配置です (2,8,1)は、1つの電子を放出するとより安定し、電子配置が次のように変化します。 (2,8). 配置(2,8,7)を持っているおよび/または持っている塩素(Cl)については、1つの電子を取得して構成が(2,8,8)になると、より安定します。 この2つがより安定するように、ナトリウムは1つの電子を提供し、塩素はナトリウムから電子を取得します。
ナトリウムが1つの電子を失うと、このナトリウムは小さくなります。 一方、1つの電子の追加により塩素は大きくなります。 したがって、正イオンのサイズは常に前のサイズよりも小さくなりますが、負イオンの場合は前のサイズよりも大きくなる傾向があります。 電子交換が発生すると、Naは正に帯電し(Na +)、Clは負に帯電します(Cl-)。 その後、Na +とCl-の間に静電力があり、イオン結合が形成されます。
上記のように、イオン結合は、ある原子から別の原子への電子の移動によって発生する結合です。 最も外側の電子が2と8の場合、これらの元素間の結合は安定していることを覚えておく必要があります。 次に、以下の元素Na(ナトリウム)とCl(塩化物)の間のイオン結合の形成の例を見てください。

イオン結合は比較的強い結合です。 室温では、これらのイオン性化合物はすべて結晶性固体であり、特定の構造を持っています。 ルイス記号を使用して、NaClの形成を次のように説明します。

ルイス電子ドット記号は、元素の記号と、元素の原子の1つの価電子を表す各点のドットで構成されます。 電子ドットは最も外側の電子です。

イオン結合特性

その比較的強い性質に加えて、このイオン結合には、次のような他のいくつかの特性もあります。
- 沸点と融点が高い。 これらの非遊離イオン性化合物の結晶中の正イオンと負イオンは、強い静電力に拘束されているために移動します。 イオンが静電力に打ち勝つために十分な運動エネルギーを獲得するには、高温が必要です。
- 硬いが壊れやすい。 正イオンと負イオンが静電気力によって全方向に強く結合するため、硬い性質を持っています。 脆い性質を持っているのは、外力を受けたときに層が移動する可能性がある、または移動する可能性があるという事実によるものです。 または、上下に重ねて、非常に強い反発が発生/表示され、その後、反発が発生する可能性があります 分離。
- 室温で固体です。
- 水溶剤に可溶ですが、有機溶剤には本質的に不溶です
- 固相では電気を通しませんが、液相では電気を通します。 物質は、電荷を帯びて自由に動くことができる、または動くことができるイオンがあれば、電気を伝導できると言われています。
イオン結合の特徴
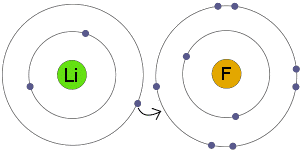
イオン結合の存在は、得られる化合物の化学的および物理的特性にも影響を与えます。 イオン結合のこれらの優れた特性のいくつかがあります。また、以下はイオン結合の次の特性のいくつかのリストです。
これらの金属は電子を失う傾向があり、非金属は電子を獲得する傾向があるという事実のために、イオン結合は金属と非金属の間で一般的です。 したがって、非金属間でのみ形成できる、または形成できる共有結合とは異なり、このようなイオン結合は、金属と非金属の間で形成できる、または形成できる。
イオン性化合物に名前を付けるときは、常にこの金属の名前が最初になり、非金属の名前が2番目になります。 たとえば、塩化ナトリウム(NaCl)の場合、ナトリウムは金属ですが、塩素は非金属です。
イオン結合を含む化合物は、水やその他の極性溶媒に容易に溶解します。 したがって、イオン結合は、得られる化合物の溶解度に影響を及ぼします。
これらのイオン性化合物を溶媒に溶解して均一な溶液を形成すると、その溶液は電気を通す傾向があります。
これらのイオン結合は、化合物の融点にも影響を及ぼします。これは、これらのイオン化合物が より高い融点、これはイオン結合がより広い温度範囲にわたって安定したままであることを意味します 大きい。
イオン結合は、正に帯電したイオンと負に帯電したイオンの間の引力によって発生します。
Wibowo(2013)が述べているように、考慮する必要のあることがいくつかあります。通常、この化学結合材料には、次の例のような概念上の誤りがあります。
- このイオン結合は、単純な陽イオンと陰イオンの間でのみ発生するか、発生する可能性があります。
- これらのイオン性化合物は、イオンなどからのみ、または直接形成することができます。
式またはイオン式でも。 これらのイオン性化合物は分子として存在しないため、イオン性化合物の分子式を知ることはできません。 代わりに、化合物のイオン式は、その化合物の実験式です。 たとえば、塩化ナトリウムの化学式はNaClです。
Saunders(2007)は、イオン格子には等量のイオンがいくつかあると述べています。たとえば、次のようになります。
- 酸化マグネシウムにはMg2 +とO2-イオンが含まれており、式はMgOです。
- 塩化カルシウムにはCa2 +イオンとCl2-イオンが含まれており、式はCaCl2です。
- この酸化アルミニウムにはAl3 +とO2-イオンが含まれており、式はAl2O3です。
NaClの例。イオン結合形成
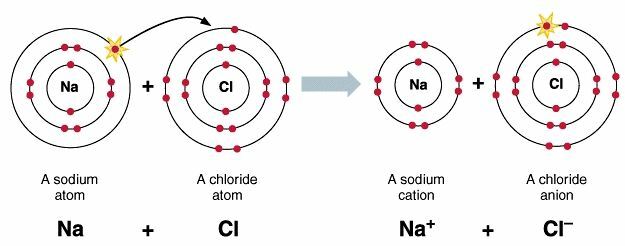
Na原子がClに近づくと、Naは特定のイオン化エネルギーを吸収し、電子を放出してNa⁺イオンに変わることができます。
Na = 2。 8. 1>はエネルギーを吸収し、Na⁺イオンを形成します
Cl = 2。 8. 7>はエネルギーを放出し、Cl⁻イオンを形成します。
Na原子から放出された電子はCl原子に受け入れられ、Cl原子はCl1イオンに変わります。 次に、この電子結合プロセスは、その電子親和力に等しい特定のエネルギーを放出します。
Na1イオンとCl1イオンの間には静電引力があり、NaClイオン性化合物が形成されます。
したがって、イオン結合の定義、用語、特性、特性、形成、および例の説明、うまくいけば、説明されていることがあなたに役立つことができます。 ありがとうございました
関連項目卵巣、構造、部品およびそれらの機能を理解する
関連項目直線運動の定義
関連項目検電器を理解する
