電子親和力、特性、タイプ、およびパターンを理解する
教育。 株式会社 ID –電子親和力は、中性原子によって放出または吸収されるエネルギーの尺度です。 外殻に電子捕獲があり、原子がイオンになる場合はガス 負。 電子親和力は正または負になります。 電子を捕獲する過程でエネルギーが放出される場合、電子親和力は負になります。 このプロセスの結果として形成される負イオンは安定しています。 1つの電子を捕獲する過程でエネルギーが吸収されると、逆のことが起こります。 このエネルギーの吸収により、形成されたイオンが不安定になります。 したがって、元素の原子に対する電子親和力の値が負であるほど、形成されるイオンはより安定します。 以下の詳細については:
電子親和力を理解する
電子親和力は、電子が原子に追加されて負のイオンを形成するときの中性原子(気相中)のエネルギーの変化(kJ / mol)として定義されます。 言い換えれば、中性原子が電子を獲得または獲得する確率。 電子親和力は、元素の周期的な特性の1つです。 放出されるエネルギーにより、電子親和力の値にはマイナス記号が付けられます。
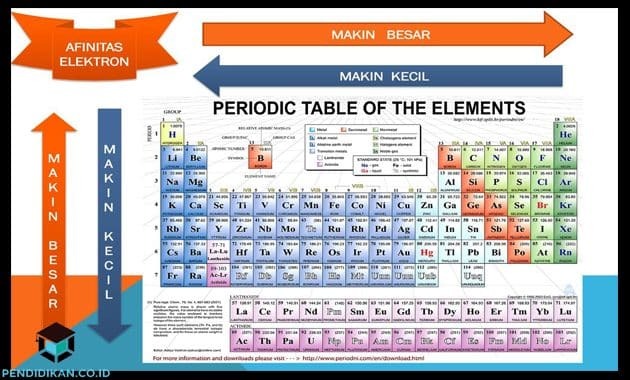
要素の周期系における電子親和力特性
- グループ内では、この電子親和力は上から下に向かって減少する傾向があります
- ある期間に、この電子親和力は左から右に増加する傾向があります。
- アルカリ土類元素と希ガスを除いて、すべての主族元素は負の電子親和力を持っています。 ハロゲンは最大の電子親和力を持っています。
電子が中性原子に追加されると、つまり最初の電子親和力が発生すると、エネルギーが放出されます。 したがって、最初の電子親和力は負です。 ただし、電子が負イオン、つまり両方の電子親和力に追加されると、より多くのエネルギーが必要になります。 したがって、負イオンは電子を電子軌道に強制的に入れる必要があるため、イオンに電子を追加できるように、より多くのエネルギーが放出されます。 したがって、2番目の電子親和力は正です。
最初の電子親和力:
- X(g)+ e-→X-(g)(1)
2番目の電子親和力:
- X-(g)+ e-→X2-(g)(2)
イオン化エネルギーは常に陽イオンの形成に関連しています。 電子親和力は負イオンの親和力であり、その使用はほとんどの場合、周期表のグループ16および17の元素に限定されます。 まず、電子親和力は、1モルの気体原子がそれぞれ電子を獲得して1モルの気体イオン-1を形成するときに放出されるエネルギーです。 これは、この変化が発生したときに放出されるエネルギー(Xのモルあたり)です。 最初の電子親和力は負の値です。 たとえば、塩素の最初の電子親和力は-349 kJ / molです。 慣例により、負の符号はエネルギーの放出を示します。
電子親和力タイプ
この電子親和力は、金属と非金属の電子親和力に分けられます。説明は次のとおりです。
金属電子親和力
金属元素に電子を加えると、その電子を得るのにエネルギーが必要になります(吸熱反応)。 金属は、電子ネットを失いやすく、陽イオンを形成しやすいため、電子を獲得する可能性が低くなります。 金属の原子核は価電子に強い引力を持たないため、価電子を失うのは簡単です。 したがって、金属はより低い電子親和力を有することが知られている。 金属に対する電子親和力が低下する傾向は次のとおりです。
リチウム(Li):60 KJ / mol
ナトリウム(Na):53 KJ / mol
カリウム(K):48 KJ / mol
ルビジウム(Rb):47 KJ / mol
セシウム(Cs):46 KJ / mol
電子親和力が1つのグループで減少することに注意してください
非金属電子親和力
非金属が電子を獲得すると、エネルギーを消費して陰イオンを形成するため、エネルギーの変化は通常負になります(発熱過程)。 したがって、電子親和力は負の数になります。
これらの非金属は、その原子構造により、金属よりも電子親和力が高くなります。
- まず、非金属は金属よりも価電子が多いため、非金属が電子を獲得して安定したオクテットを満たしやすくなります。
- 第二に、電子の価電子殻は原子核に近いため、電子を取り除くのがより難しく、他の元素(特に金属)から電子を引き付けやすくなります。
したがって、これらの非金属は金属よりも高い電子親和力を持っています。つまり、電子親和力が低い原子から電子を獲得する可能性が高くなります。
たとえば、グループ17のハロゲン系列の元素などの非金属は、金属よりも高い電子親和力を持っています。 この傾向は次のように説明されます。 エネルギーが放出されることを示す、または示す電子親和力の負の符号(-)を見てください。
フッ素(F):-328 kJ / mol
塩素(Cl):-349 kJ / mol
臭素(Br):-324 kJ / mol
ヨウ素(I):-295 kJ / mol
電子親和力はグループが進むにつれて減少しますが、周期とともに増加することに注意してください。
電子親和力パターン
この電子親和力は、周期表の期間中、グループに対して、また左から右へと増加します。 電子は原子核に近づくようにエネルギー準位に追加されるため、原子核と原子核の間には強い引力があります。 電子。 距離が遠いほど、魅力が少なくなることを忘れないでください。 したがって、電子が軌道から追加されたときに放出されるエネルギーは少なくなります。 それとは別に、元素が持つ価電子が多いほど、安定したオクテットを形成するために電子を獲得する可能性が高くなります。 原子の価電子が少ないほど、電子を獲得する可能性が高くなります。
電子親和力は、周期表の周期全体でグループを下に向かって右から左に減少します。 電子は原子核から離れてより高いエネルギーレベルに配置されるため、 引いて。 しかし、価電子の数が増減するにつれて、元素はより安定し、より高い電子親和力を持たなければならないと考えるかもしれません。 シールドの影響を説明することはできません。 1周期が短くなると、シールド効果が大きくなり、電子間に反発が発生します。 そのため、周期表の降順グループの1つとして、電子と原子核の間の引力が減少します。
これですべてです。電子親和力、プロパティ、タイプ、およびパターンの定義についてお読みいただき、ありがとうございます。お役に立てば幸いです。
関連項目胸骨を理解する
関連項目唾液腺(唾液腺)の定義
関連項目中心小体の定義
