Faraday törvény anyaga: hangok, képletek, példaproblémák
Betöltés...
Tudod, mi az a Faraday-törvény? Az egyik törvény az elektromágnesességhez kapcsolódik, és előrejelzéseket ad az elektromos áramkörök és a mágneses mezők közötti kölcsönhatásokról, hogy azok elektromotoros erőket hozhassanak létre.
Michael Faraday brit tudós fedezte fel 1833-ban, de máig is használják, és bizonyos területeken nagyon hasznos. Szeretné tudni, hogy mit jelent, és egy példát a kérdésre?
Tartalomjegyzék
Faraday 1. törvénye

Két Faraday-törvény létezik, az első az elektrolízis és az elektromos töltés folyamatára vonatkozik.
Ez így szól: "Az elektrolízis folyamata során az elektródából előállított anyag tömege egyenesen arányos lesz a felhasznált elektromos töltés mennyiségével."
A használt egyenletek a következők:
W Q
W = egy anyag tömege
Q = elektronok elektromos töltése
A felhasználások a következők:
Q = i x t
i = elektromos áram (amperben)
t = idő (másodpercben)
Azzal a magyarázattal, hogy az elektromos töltések felhasználásának összege az eredmény egyenlő lesz az áramerősség időbeli szorzatával.
Ezen túlmenően több hasonlóság is van a fenti joghasználat eredményei között, így:
w I x ta
Ami az alkalmazásában használt képletet illeti:
W = e.i.t/F
Információ:
W = az elektrolízis során előállított anyag tömege (grammban)
e = egyenértékű tömeg
i = áramerősség (amperben)
t = idő (másodpercben)
F = Faraday-féle meghatározás 96 500 Coulomb/mol határozott számmal.
Faraday törvényének alkalmazása a kémia világában számos, az elektromos árammal és az elektrolízissel kapcsolatos összetevőn keresztül látható.
Mint az elektromos generátorban, amely egy speciális eszköz, amelynek feladata, hogy mechanikai forrásokon keresztül elektromos energiát állítson elő és elektromágneses indukciót használjon. A generátoroknak két típusa van: az áram oda-vissza és közvetlen.
A következő alkalmazás egy dinamó, amelynek két típusa van, nevezetesen váltóáramú és egyenáramú.
Olvas: Kirchhoff törvénye
Faraday 2. törvénye

Faraday 1. törvénnyel ellentétben van egy másik másodperc, amelynek hangja „Az anyag tömege, amelyet egy elektródát az elektrolízis folyamata során, egyenesen arányos lesz az anyag egyenértékű tömegével az.
Míg az anyag tömege alatt az anyag tömegét értjük, amely a törvény alkalmazásában van. Ekkor az ekvivalens tömeg egy olyan anyag tömege, amelynek sztöchiometrikusan ugyanannyi mólja van, mint 1 mól elektronnak.
Az egyenlet a következő:
Anyag tömege anyag tömegegyenértéke
w ME
ME = az ion/Ar oxidációs állapota vagy töltése
A második törvény alkalmazásában használt képlet a következő:
W1/W2 = e1/e2
Információ:
W1 = az első anyag tömege (grammban)
W2 = a második anyag tömege (grammban)
e1 = az első anyag egyenértékű tömege
e2 = a második anyag egyenértékű tömege
Ennek a második törvénynek az alkalmazásában az ekvivalens tömegfüggvény nagyon fontos. Osztva az oxidációs szám változásával, amely az elektrolízis reakciójában következik be.
Az egyenlet a következő:
Mtölgy = Ar
Az oxidációs szám változása
A sztöchiometrikus alapfogalmakra hivatkozva összefüggés van a tömeg, a mo száma és a moláris tömege között, ami szorosan összefügg Faraday 1. és 2. törvényének együttes használatával.
Az egyenlet a következő:
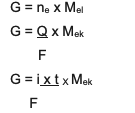
Az összefoglaló a és a 2 közötti kombinált egyenlet, nevezetesen:
Hirdetés
G ~ i x t x Mtölgy
Információ:
G = a termék tömege (grammban)
Q = elektromos töltés (coulomb egységekben)
i = az elektromos áram erőssége (amperben)
t = idő (másodpercben)
Mtölgy= az anyag egyenértékű tömege (gramm/mol-ban)
F = Faraday-állandó, amely 96 500 coulomb/mol)
Olvas: Hooke törvénye
Példa a Faraday-törvény problémájára
A Faraday-törvény alkalmazásának jobb megértése érdekében íme néhány példa az alkalmazására.
1. 1. példa
Egy elektromos áramkörben 5 grammos rézlerakódás történt. Mekkora tömegű Ag csapódott ki az elektródáknál? További információ: Ag = 108 és Cu = 63,5.
Ahhoz, hogy a képlet megtalálja az Ag vagy W tömegétAg használhatja a következő képletet:
WCu = ÉNCu
WAg= ÉNAg
ME az = egyenlettel ismert Ar
Oxidációs szám = 2
Ismert:
WCu = 5 gramm
Először számítsa ki a két anyag ME értékét a réz és az Ag redukciós reakcióinak felhasználásával az alábbiak szerint:
Cu2+ + 2e– → Cu(s), MEcu
= Ar = 63,5
Oxidációs szám =2
= 31,75
Ag+ + e– → Ag(s) MEAg
= Ar = 108
Oxidációs szám = 1
= 108
következő 5gCu = 31.75
WAg 108
= 17
Tehát a leülepedő Ag tömege = 17 gramm.
2. 2. példa
Hány Faraday kell a Ca ionok redukálásához?2+ 12 grammos mennyiséggel? Íme a vita:
kb2+→ a vegyérték 2
A Ca Ar értéke 40
A használt képlet W = e x F
Hol található F = W/e
A válasz:
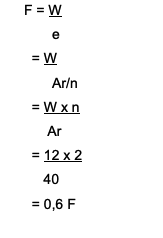
Tehát a Ca-ionok redukálásához 0,6 Faraday szükséges2+ ami 12 grammot tesz ki.
Olvas: Coulomb törvénye
3. 3. példa
0,2 amperes elektromos áramot hagynak folyni 50 percig, majd belép a CuCl-oldatot tartalmazó elektrolizáló cellába.2. Mennyi réz csapadék képződik a katódon? További információként a rézből származó Ar = 63,5
Ismert:
Áram az I szimbólummal = 0,2 amper
Az idő t = 50 perc, ha másodpercben használjuk, 50 x 60 másodperc, ami 3000 másodperc
Kérdezte: WCu?
Válasz: Először írja le a rézredukciós reakciót, nevezetesen:
Cu2+ (aq) + 2e+ → Cu(k)
NEKEMCu = Ar
Oxidációs szám = 63,5/2
= 31,75
A W megtalálásához használt képletcu ez:
Wcu = (1/96 500) x i x t x MEcu
= (1/96 500) x 0,2 A x 3000 s x 31,75
= 0,197 gramm
Tehát a réz lerakódás értéke 0,197 gramm.
4. 4. példa
Szén típusú elektródával végzett elektrolízis során 12,7 grammos Cu típusú csapadékot tudott előállítani. 4 amperes elektromos áramot használ. Mennyi ideig tart az elektrolízis?
Ismert:
Cu Ar = 63,5
Kérdezte: W?
Válasz:

Tehát az elektrolízis ideje 9650 másodperc a Faraday-törvényből származó képlet alapján.
Azoknak, akik kémiát tanulnak, természetesen valóban szükségük lesz Faraday törvényének megfelelő megértésére. Hogy jogalkalmazással kapcsolatos feladatot kapva a már rendelkezésre álló képletek segítségével helyesen és alaposan meg tudjon válaszolni.
X ZÁRVA
Reklámok
HIRDETÉS
X ZÁRVA
